支气管哮喘是世界范围内严重威胁公众健康的慢性病,据估计全球有约3亿哮喘患者,其中我国超过2千万,且儿童哮喘患病率高于成人,是严重威胁青少年身体健康的疾病之一[1]。现有的治疗包括糖皮质激素(Glucocorticoid, GC)作为目前治疗哮喘的一线药物能有效控制气道炎症,却不能彻底改善哮喘患者肺功能和减轻气道重塑的发生[2],且治疗剂量的GC引起一系列包括血糖升高、青光眼、骨质疏松、皮肤萎缩和生长迟缓等副作用[3-4];受试者长期使用标准剂量的β激动剂会减少循环单核细胞[5]、气道上皮细胞、支气管肺泡灌洗液中巨噬细胞[6]β2激动剂受体的表达和激动剂刺激引起的cAMP的产生。能否在现有的药物中找出一种价廉易得而且安全的药物,用于改善哮喘患者肺功能呢?氯喹(chloroquine, CQ)自19世纪50年代始用于治疗免疫介导的炎症紊乱,如风湿性关节炎、系统性红斑狼疮和干燥综合征[7]。CQ通过稳定巨噬细胞的溶酶体,减少对糖皮质激素受体(glucocorticoid receptor, GR)的降解进而促进GC发挥治疗风湿性关节炎作用[8]。体外实验表明[9-10],在β2-肾上腺素受体耐受的情况下,CQ浓度依赖性地激活苦味受体促进气道平滑肌松弛。然而,氯喹对哮喘小鼠气道高反应性的作用尚未见报道。病毒感染是哮喘发作的重要诱因,有研究显示[11],呼吸道合胞病毒(respiratory syncytial virus, RSV)可延迟中性粒细胞和嗜酸性粒细胞凋亡,IL-6参与了这种抗凋亡效应,而预先用氯喹处理则可废除这种抗凋亡效应。本研究旨在探讨CQ是否能抑制哮喘小鼠气道高反应性、减少哮喘小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中嗜酸性粒细胞和中性粒细胞数,为其临床用于抗哮喘治疗提供理论依据。
1 材料与方法 1.1 动物分组及哮喘模型的建立3周龄大小SPF级Balb/c小鼠购自重庆医科大学实验动物中心,饲养于重庆医科大学附属儿童医院动物房,恒定室温(21~25 ℃),过滤空气,湿度50%~65%,光照10~12 h/d,不含OVA的饲料、水皆经消毒处理后使用,整个实验过程按动物保护和使用指导方针进行。本研究获得重庆医科大学附属儿童医院伦理委员会的批准。将小鼠随机分为对照组(control, C)、哮喘组(asthma, A)、氯喹治疗组(CQ)、糖皮质激素治疗组(dexamethasone, D)、氯喹+糖皮质激素治疗组(C+D),除对照组外,其余各组小鼠均于第0天、第14天给予100 μl PBS(含100 μg OVA)+100 μl氢氧化铝凝胶(Sigma公司)共200 μl腹腔注射致敏,第21天起给予5 ml 1% OVA高频雾化吸入进行激发,每天1次,每次30 min,连续7 d,治疗组于每次雾化前腹腔注射预先配好的含有不同浓度、不同治疗药物的冷PBS溶液200 μl,哮喘组则予200 μl冷PBS腹腔注射。对照组在相同时间给予冷PBS腹腔注射致敏、雾化吸入激发、激发前腹腔注射。
1.2 气道高反应性测定最后1次雾化激发后24 h内测定小鼠气道高反应性,小鼠清醒状态下通过体积描记法检测小鼠自主呼吸,待检测的小鼠用PBS或者不同质量浓度的乙酰甲胆碱(3.125l、6.25、12.5、25、50 mg/ml)雾化3 min,休息2 min后连续记录读数5 min并取其平均值,气道高反应性曲线表示为雾化不同质量浓度乙酰甲胆碱后的气道阻力enhanced pause(Penh),Penh=PEP/ PIP×pause。
1.3 支气管肺泡灌洗将小鼠眼球取血后断颈处死,仰卧位固定,暴露气管,用留置针进行气管插管并固定,用灭菌冷PBS进行支气管肺泡灌洗,每次0.5 ml,共3 ml(回抽率>80%),4 ℃低温离心机2500 r/min离心5 min,上清按300 μl/管分装后保存于-80 ℃,取1 ml无菌PBS液加入肺泡灌洗液离心后下层细胞中混匀后细胞计数,细胞计数后再次4 ℃低温离心机2500 r/min离心5 min,弃上清,细胞沉渣涂片自然干燥后进行瑞氏染色细胞分类计数。
1.4 肺组织病理评分小鼠眼球取血后断颈处死,仰卧位固定,暴露胸廓,取左肺组织固定于4%甲醛溶液至少24 h,梯度乙醇脱水后常规石蜡包埋,切片(4 μm),HE染色后光镜下观察。根据文献[12]分别进行肺组织支气管细支气管周围炎症、血管周围炎症、肺泡周围炎症进行评分。
1.5 BALF中IL-6、PGF2α水平检测取储存于-80 ℃的BALF上清,用ELISA方法检测IL-6、PGF2α水平(所有实验按说明书步骤操作)。IL-6试剂盒购于北京四正柏试剂公司。PGF2α试剂盒购于Enzo。
1.6 统计学分析数据用均数±标准差表示,采用Graphad prism5.0统计软件,多组间比较采用One-way ANOVA (and nonparametric)检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠BALF细胞计数和分类计数比较结果正常小鼠BALF中主要为淋巴细胞和巨噬细胞,而嗜酸性粒细胞和中性粒细胞含量甚少。哮喘组小鼠BALF中细胞总数、嗜酸性粒细胞比例、中性粒细胞比例均明显高于对照组(P < 0.001),提示哮喘组小鼠气道炎症较对照组明显;CQ可明显降低哮喘小鼠BALF中细胞总数和嗜酸性粒细胞比例(P < 0.001)、中性粒细胞比例(P < 0.01)。与D合用后细胞总数、嗜酸性粒细胞比例均较单独使用D效果更好(表 1)。
| 表 1 支气管肺泡灌洗液细胞总数和白细胞分类 Table 1 Number of the total cells and leukocyte subsets in the BALF (Mean±SD) |
哮喘组小鼠肺组织支气管细支气管周围炎症(P <0.001)、血管周围炎症(P <0.001)、肺泡间隔炎症(P <0.01)较对照组显著加重,病理评分较对照组明显增高(P <0.001);CQ可显著降低哮喘小鼠病理评分(P <0.05);D可显著减轻哮喘小鼠肺组织血管周围炎症(P <0.05);氯喹+地塞米松组小鼠支气管细支气管周围炎症(P <0.05)、血管周围炎症(P <0.01)较哮喘组显著减轻,病理评分较哮喘组明显降低(P <0.001)。两药合用较单独用药时效果更好(图 1,表 2)。
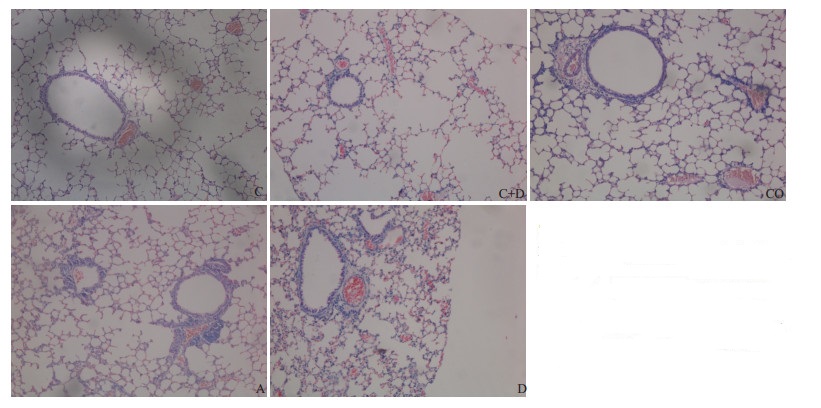
|
图 1 各组小鼠肺组织病理切片HE染色 Figure 1 Pathological changes of the lung tissues of the mice in each group (HE staining, original magnification: ×100). C: Cibtrikm; C + D: Asthma; CO: Asthma treated with chlorlquine; A: Asthma treated with dexamethasone; D: Treated with chloroquine and dexamethasone. |
| 表 2 各组小鼠肺组织病理评分 Table 2 Histopathological score of lung tissues in mice of each group |
随吸入乙酰甲胆碱质量浓度的增加,各组小鼠气道高反应性也有所增加,但增加的幅度不同,如下图,乙酰甲胆碱的质量浓度从25 mg/ml(6.1±0.9 vs 2.0±0.2)(P < 0.001)起至50 mg/ml(8.2±1.0 vs 2.2±0.1)(P < 0.001),哮喘组的气道反应性明显高于对照组;CQ可明显降低哮喘小鼠的Penh,Ach的质量浓度25 mg/ml(4.5±0.4 vs 6.1±0.9)(P < 0.05),50 mg/ml(4.6±0.5 vs 8.2±1.0)(P < 0.001),与地塞米松降低哮喘小鼠Penh相当;两药合用时,可见在Ach的质量浓度50 mg/ml时较地塞米松单独作用Penh更低(图 2)。
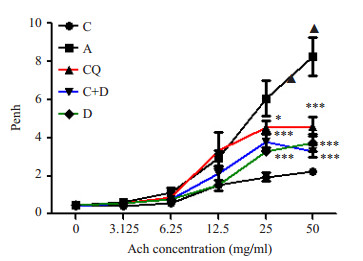
|
图 2 各组小鼠在不同浓度乙酰甲胆碱吸入时呼气阻力的变化 Figure 2 Expiratory resistance after methacholine challenge in different groups. *P < 0.05, ***P < 0.001. |
BALF中IL-6哮喘组较对照组显著升高(P < 0.05),氯喹+地塞米松组BALF中IL-6较哮喘组显著降低(P < 0.05)。BALF中PGF2α哮喘组较对照组有所升高,CQ较哮喘组有所降低,但差异均不具有显著性。地塞米松治疗组BALF中PGF2α较哮喘组显著降低(P < 0.01),氯喹+地塞米松组BALF中PGF2α较哮喘组显著降低(P < 0.001),较地塞米松单独用药效果更好(图 3)。
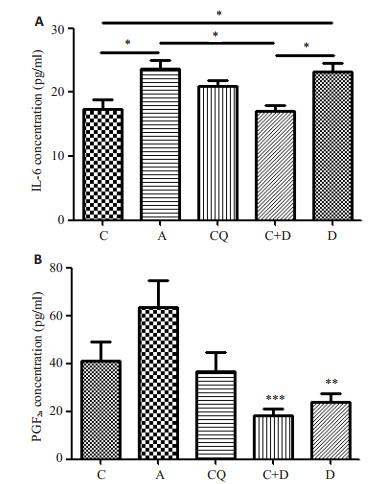
|
图 3 各组小鼠支气管肺泡灌洗液IL-6(A)和PGF2α(B)水平 Figure 3 Changes of IL-6 (A) and PGF2α (B) in the BALF in each group. *P < 0.05, **P < 0.01, ***P < 0.001 vs asthma group. |
支气管哮喘是由多种细胞和细胞组分参与的气道慢性炎症性疾病,这种慢性炎症与气道高反应性相关,其具体发病机制至今尚未完全清楚。气道高反应性表现为气道对各种刺激因子出现过强或过早的收缩反应,是哮喘发生发展的重要因素。本研究在小鼠清醒无约束的状态下测定肺功能,以Penh作为气道缩窄的指数来反映气道高反应的程度[13-15],即Penh值越高,气道反应性越高。本研究结果显示,哮喘组小鼠在吸入25 mg/ml、50 mg/ml乙酰甲胆碱时Penh均较对照组明显升高(P < 0.001),证明哮喘组小鼠存在气道高反应性。400 μg CQ+4 μg D腹腔注射,可明显改善风湿性关节炎小鼠的症状[8]。体外实验表明[9-10],即使有β2-肾上腺素受体的耐受,CQ浓度依赖性地激活苦味受体促进气道平滑肌松弛。本研究发现,400 μg的CQ在每次OVA雾化激发前腹腔注射即可明显降低哮喘小鼠的Penh(P < 0.001),与D(P < 0.001)作用相当,说明CQ可抑制哮喘小鼠气道高反应性,与文献[9-10]结果一致。
病毒感染常诱发哮喘发作,IL-6参与了RSV延迟中性粒细胞和嗜酸性粒细胞凋亡的效应,预先用氯喹处理则可废除这种抗凋亡效应;抑制NF-κB可抑制IL-6的产生[11]。中性粒细胞和嗜酸性粒细胞是哮喘发生发展的重要参与者,这些细胞的凋亡延迟可能是哮喘发生发展的重要原因。用氯喹抑制这种抗凋亡效应则能起到保护哮喘的作用。本研究发现,哮喘组小鼠BALF中炎症细胞数量(P < 0.001)、嗜酸性粒细胞比例(P < 0.001)、中性粒细胞比例(P < 0.01)均较对照组显著升高。CQ治疗可显著降低哮喘小鼠BALF中炎症细胞数量(P < 0.01)、嗜酸性粒细胞比例(P < 0.001)、中性粒细胞比例(P < 0.01)。D治疗亦可显著减少哮喘小鼠BALF中炎症细胞数量(P < 0.001)、嗜酸性粒细胞比例(P < 0.001)、中性粒细胞比例(P < 0.001)。两药合用效果更好。二者合用时可显著降低哮喘小鼠BALF中的炎症因子IL-6水平(P < 0.05),较D治疗组BALF中IL-6水平显著降低(P < 0.05)。哮喘小鼠气道周围炎症(P < 0.001)、血管周围炎症(P < 0.001)、肺泡间质炎症(P < 0.01)和肺组织病理评分(P < 0.001)较对照组小鼠显著升高。CQ可明显降低哮喘小鼠肺组织病理评分(P < 0.05),D可显著降低哮喘小鼠血管周围炎症(P < 0.05)评分,CQ与D合用时则可显著降低哮喘小鼠气道周围炎症(P < 0.05)、血管周围炎症(P < 0.01)和肺组织病理评分(P < 0.001)。二者合用较单独用药效果更好。结果提示,在哮喘小鼠,D与CQ合用可更好地抑制IL-6产生,减少BALF中中性粒细胞和嗜酸性粒细胞发挥抗哮喘炎症的作用。
研究发现[8],在培养的巨噬细胞中,CQ和GC可协同转录抑制编码PLA2G4A和若干趋化因子的基因。cPLA2具有游离Ca+依赖性地选择性的作用于花生四烯酸[16-19]。有研究报道,豚鼠变应性哮喘时,肺组织磷脂酶A2(phospholipaseA2, PLA2)活性提高,用氯喹预处理后,则PLA2活性降低[20]。PGF2α作为PLA2作用于花生四烯酸的一种重要的下游产物,作用于气道平滑肌时,使气道平滑肌收缩。本实验结果显示,哮喘组PGF2α水平较对照组有所升高,但差异不具有显著性,考虑与对照组例数过少且对照组和哮喘组组内变异均较大有关,同时,哮喘小鼠本身存在气道高反应性,引起其气道平滑肌收缩所需PGF2α阈值较正常小鼠低,一定程度升高的PGF2α即可引起哮喘小鼠气道平滑肌收缩。CQ可一定程度降低哮喘小鼠BALF中PGF2α水平,但差异不具有显著性,考虑可能与CQ治疗组和哮喘组组内变异均较大有关。D可显著降低哮喘小鼠BALF中PGF2α水平(P < 0.01),CQ与D合用可明显的降低哮喘小鼠BALF中PGF2α水平(P < 0.001)。结果提示,PGF2α参与了小鼠哮喘气道平滑肌的收缩,D可抑制PGF2α的产生,发挥舒张气道平滑肌的作用,与CQ合用可更好地抑制PGF2α的产生,取得更好的效果。活体小鼠体内自身存在低水平的D,故CQ单独使用时,也可一定程度降低PGF2α水平。其具体机制有待进一步实验证实,可能CQ作为一种溶酶体抑制剂,抑制了对GR的降解,而促进D发挥抗炎作用。
综上所述,CQ可抑制哮喘小鼠气道高反应性;与D合用可抑制IL-6产生,减少BALF中中性粒细胞和嗜酸性粒细胞发挥抗哮喘炎症的作用;与D合用可更好地抑制PGF2α的产生,促进气道平滑肌舒张。临床与D合用可能减少D使用剂量,促进其发挥抗炎作用。
| [1] | Bacharier LB, Boner A, Carlsen KH, et al. Diagnosis and treatment of asthma in childhood:a PRACTALL consensus report[J]. Allergy,2008, 63 (1) : 5-34. |
| [2] | Freishtat RJ, Nagaraju K, Jusko WA. Glucocorticoid efficacy in asthma:is improved tissue remodeling upstream of AntiInflammation[J]. J Investig Med,2010, 58 (1) : 19-22. DOI: 10.2310/JIM.0b013e3181b91654. |
| [3] | Schäcke H, Döcke WD, Asadullah K. Mechanisms involved in the side effects of glucocorticoids[J]. Pharmacol Ther,2002, 96 (1) : 23-43. DOI: 10.1016/S0163-7258(02)00297-8. |
| [4] | Stanbury RM, Graham EM. Systemic corticosteroid therapy-side effects and their management[J]. Br J Ophthalmol,1998, 82 (6) : 704-8. DOI: 10.1136/bjo.82.6.704. |
| [5] | Brodde OE, Brinkmann M, Schemuth R, et al. Terbutaline-induced desensitization of human lymphocyte beta2-adrenoceptors.Accelerated restoration of beta-adrenoceptor responsiveness by prednisone and ketotifen[J]. J Clin Invest,1985, 76 (3) : 1096-101. DOI: 10.1172/JCI112063. |
| [6] | Turki J, Green SA, Newman KB, et al. Human lung cell beta2-adrenergic receptors desensitize in response to in vivo administered beta-agonist[J]. Am J Physiol,1995, 269 (5Pt1) : L709-14. |
| [7] | Sun S, Rao NL, Venable J, et al. TLR7/9antagonists as therapeutics for immune-mediated inflammatory disorders[J]. Inflamm Allergy Drug Targets,2007, 6 (4) : 223-35. DOI: 10.2174/187152807783334300. |
| [8] | He Y, Xu Y, Zhang C, et al. Identification of a lysosomal pathway that modulates glucocorticoid signaling and the inflammatory response[J]. Sci Signal,2011, 4 (180) : ra44. |
| [9] | An SS, Wang WC, Koziol-White CJ, et al. TAS2R activation promotes airway smooth muscle relaxation despite beta (2)-adrenergic receptor tachyphylaxis[J]. Am J Physiol Lung Cell Mol Physiol,2012, 303 (4) : L304-11. DOI: 10.1152/ajplung.00126.2012. |
| [10] | Deshpande DA, Wang WC, Mcilmoyle EL, et al. Bitter taste receptors on airway smooth muscle bronchodilate by localized Calcium signaling and reverse obstruction[J]. Nat Med,2010, 16 (11) : 1299-304. DOI: 10.1038/nm.2237. |
| [11] | Lindemans CA, Coffer PJ, Schellens IM, et al. Respiratory syncytial virus inhibits granulocyte apoptosis through a phosphatidylinositol3-kinase and NF-kappaB-dependent mechanism[J]. J Immunol,2006, 176 (9) : 5529-37. DOI: 10.4049/jimmunol.176.9.5529. |
| [12] | 邓昱.IL-12+重组卡介苗新生期接种干预实验性哮喘模型的作用及其机制研究[D].重庆:重庆医科大学, 2010. |
| [13] | Zang N, Xie X, Deng Y, et al. Resveratrol-mediated gamma interferon reduction prevents airway inflammation and airway hyperresponsiveness in respiratory syncytial virus-infected immunocompromised mice[J]. J Virol,2011, 85 (24) : 13061-8. DOI: 10.1128/JVI.05869-11. |
| [14] | Deng Y, Chen W, Zang N, et al. The antiasthma effect of neonatal BCG vaccination does not depend on the Th17/Th1but IL-17/IFN-γ balance in a BALB/c mouse asthma model[J]. J Clin Immunol,2011, 31 (3) : 419-29. DOI: 10.1007/s10875-010-9503-5. |
| [15] | Ye ZH, Huang Y, Liu D, et al. Obesity induced by neonatal overfeeding worsens airway hyperresponsiveness and inflammation[J]. PLoS One,2012, 7 (10) : 0047013. DOI: 10.1371/journal.pone.0047013. |
| [16] | Clark JD, Lin LL, Kriz RW, et al. A novel arachidonic acid-selective cytosolic PLA2contains a Ca (2+)-dependent translocation domain with homology to PKC and GAP[J]. Cell,1991, 65 (6) : 1043-51. DOI: 10.1016/0092-8674(91)90556-E. |
| [17] | Hayakawa M, Ishida N, Takeuchi K, et al. Arachidonic acidselective cytosolic phospholipase A2is crucial in the cytotoxic action of tumor necrosis factor[J]. J Biol Chem,1993, 268 (15) : 11290-5. |
| [18] | Kessen UA, Schaloske RH, Stephens DL, et al. PGE2release is Independent of upregulation of Group V phospholipase A2during long-term stimulation of P388D1cells with LPS[J]. J Lipid Res,2005, 46 (11) : 2488-96. DOI: 10.1194/jlr.M500325-JLR200. |
| [19] | Shinohara H, Balboa MA, Johnson CA, et al. Regulation of delayed prostaglandin production in activated P388D1macrophages by group IV cytosolic and group V secretory phospholipase A2s[J]. J Biol Chem,1999, 274 (18) : 12263-8. DOI: 10.1074/jbc.274.18.12263. |
| [20] | Yan GT. Changes in activity of phospholipase A2and its metabolic production of prostaglandins in lung tissue of asthmatic Guinea pigs[J]. Zhonghua Jie He He Hu Xi Za Zhi,1992, 15 (2) : 89-91. |
 2015, Vol. 35
2015, Vol. 35
