2. 重庆医科大学附属第一医院神经内科,重庆 400016
2. Department of Neurology, First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
脑卒中具有高发病率、高致残率、高致死率和高复发率的特点,目前已成为人类致残和死亡的重要原因之一,也是我国国民第1位的死亡原因,死亡率高于欧美国家的4~5倍。脑血管病给社会和家庭带来了沉重的经济负担,但对于脑血管病造成的中枢神经系统损伤仍缺乏有效的治疗,因此,积极寻求神经保护剂是目前研究的首要任务。
米诺环素是一种半合成的高脂溶性四环素类抗生素,能有效地通过血脑屏障。近年来的研究表明米诺环素是目前最有前途的神经保护剂,具有抑制小胶质细胞的激活、半胱天冬酶-1依赖的细胞凋亡及抗氧化应激等药理作用。最近一项临床研究表明,米诺环素能促进急性缺血性卒中患者神经功能的恢复[1]。血红素加氧酶-1(HO-1)是机体最重要的内源性保护体系之一,上调HO-1蛋白的表达可缓解缺血性脑损伤[2]。PC12细胞被广泛应用于模拟体外神经元损伤的研究。本课题组前期的研究表明,米诺环素可减轻缺氧缺糖损伤所致PC12细胞的损伤,并上调HO-1基因及蛋白的表达,但其机制仍不明确。
本研究通过体外培养PC12细胞,建立氧糖剥夺(OGD)损伤模型模拟在体脑缺血,观察米诺环素对PC12细胞OGD损伤的保护作用,并进一步探讨其保护作用是否通过诱导胞外信号调节蛋白激酶1/2(ERK1/ 2)信号通路上调PC12细胞中HO-1的表达。
1 材料与方法 1.1 材料与试剂高分化PC12细胞株购于中国科学院上海细胞库。三气培养箱(美国Thermo公司)。DMEM培养基、胎牛血清、DMEM无糖培养基(美国Gibico公司)。四甲基偶氮唑蓝(MTT)、盐酸米诺环素购自Sigma公司。抗HO-1多克隆抗体(Santa Cruz公司);兔抗p-ERK1/2抗体、兔抗ERK1/2抗体及兔抗GAPDH抗体(美国CST公司);鼠抗β-actin多克隆抗体(北京四正柏公司);磷酸化蛋白及全蛋白提取试剂盒(南京凯基生物公司);BCA蛋白浓度测定试剂盒及MEK抑制剂U0126购于碧云天生物技术研究所。
1.2 细胞培养及实验分组PC12细胞用DMEM完全培养基(含10%胎牛血清,100 U/ml青霉素和100 μg/L链霉素),置于37 ℃、5% CO2及饱和湿度的孵箱中常规培养。隔天换液,待细胞铺满瓶底80%~90%时,用0.25%胰蛋白酶消化,按1:3传代,收获第5~8代PC12细胞用于以下实验。取处于对数生长期的PC12细胞以2×105/ml,每孔100 μl接种在96孔板用于MTT实验,以1×106/ml密度接种于75 cm2培养瓶(Western blotting检测)。细胞随机分为4组:正常对照(Normal)组、缺氧缺糖(OGD)组、米诺环素治疗(MC)组和MEK1/2抑制剂(U0126)组。米诺环素在细胞缺氧的同时加入,U0126 (10 μmol/L)在缺氧前60 min加入。
1.3 细胞OGD的建立及药物干预参照并改进Singh等[3]报道的PC12细胞氧糖剥夺模型。当细胞培养12 h后,用PBS清洗3遍,换用无血清无糖DMEM培养基,并将细胞置于含5% CO2、94% N2、1% O2、37 ℃的三气培养箱中分别培养6 h,然后换成无血清的DMEM培养液,置于正常培养环境继续培养24 h模拟再灌注。正常对照组加入DMEM完全培养基,置于常规培养箱培养。不同浓度的米诺环素(0.1、1、10 μmol/L)在OGD及再灌注的全过程加入。
1.4 MTT法测定PC12细胞存活率复氧24 h后,96孔板细胞加入10 μl/孔MTT溶液(5 mg/ml),置于培养箱继续孵育4 h,轻轻吸弃培养液,每孔加入100 μl DMSO,置于摇床上振荡10 min。待结晶完全溶解后,用酶标仪测定各孔在570 nm波长处的吸光度值,每组6孔,重复3次实验。以正常对照组MTT吸光值为基数100%,模型组及药物干预组细胞存活率按公式计算:细胞存活率(%)=(D570处理组平均值/ D570正常对照组平均值)×100%。
1.5 免疫印迹法检测HO-1、ERK1/2、p-ERK1/2蛋白表达复氧24 h后,按照全蛋白提取试剂盒说明书以每2×106个细胞加入100 μl裂解液,冰上振荡及离心后,收集上清置于EP管并用BCA蛋白浓度测定试剂盒检测蛋白浓度。以20 μg蛋白/样品上样,10%变性不连续聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜及封闭后加入特异性一抗HO-1、p-ERK1/2、ERK1/2,β-actin及GAPDH抗体4 ℃孵育过夜,二抗孵育1.5 h后,在Bio-Rad凝胶扫描成像系统显影拍照。使用Quantity One图像分析软件测定各条带的光密度积分值(OD值),目的条带与内参光密度的比值作为该蛋白表达的相对含量。
1.6 统计学分析采用SPSS 17.0软件包对各组数据进行统计学处理。计量资料以平均数±标准差表示,各组间的比较采用单因素方差分析,两两比较采用LSD检验。检验水准α=0.05,P < 0.05表示差异有统计学意义。
2 结果 2.1 米诺环素对PC12细胞OGD损伤后细胞存活率的影响MTT结果显示,OGD 6 h造成PC12细胞严重损害,细胞存活率(47.9±1.4)明显低正常对照组(100%,P < 0.01),米诺环素(0.1、1、10 μmol/L)能缓解OGD损伤造成PC12细胞存活率的下降(71.4±2.9 vs 77.5±1.8vs56.3±2.3),与模型组比较均有统计学意义(P < 0.05),其中1 μmol/L保护作用最明显。
2.2 米诺环素对PC12细胞OGD损伤后HO-1蛋白表达的影响Western blotting检测结果显示,正常对照组PC12细胞HO-1蛋白仅有少量表达(0.31±0.07),OGD 6 h复氧后PC12细胞HO-1蛋白(0.99±0.08)表达明显高于正常对照组(P < 0.05),0.1、1、10 μmol/L米诺环素处理PC12细胞后HO-1蛋白含量分别为1.33±0.12、1.71±0.05和0.84±0.05,呈浓度依赖性逐渐增加(图 1)。为保证结果的稳定性,我们选取最佳浓度1 μmol/L米诺环素进行后续研究。
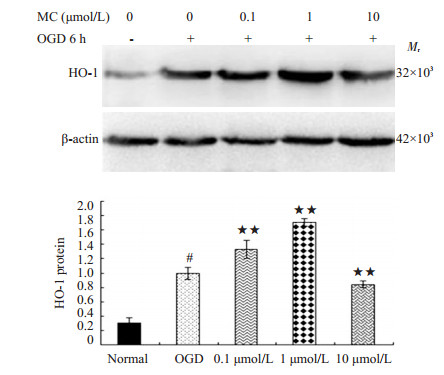
|
图 1 米诺环素对PC12细胞OGD损伤后HO-1蛋白表达的影响 Figure 1 Effects of minocycline on HO-1 protein expression in PC12 cells after OGD injury. ﹟P < 0.05 vs normal group; ★★P < 0.05 vs OGD group. |
本研究进一步观察ERK信号通路是否参与米诺环素对PC12细胞OGD损伤后的保护作用。Western blotting结果显示,各组间总ERK1/2蛋白的表达差异无统计学意义。正常对照组p-ERK1/2蛋白仅有少量表达,OGD组ERK1/2蛋白磷酸化水平较正常组有轻度增加,但差异无统计学意义(P > 0.05)。同OGD组(1.55±0.16)比较,1 μmol/L米诺环素(7.19±0.84)处理可明显增加ERK1/2的磷酸化水平(P < 0.01),U0126(10 μmol/L)能有效抑制p-ERK1/2的表达(图 2)。
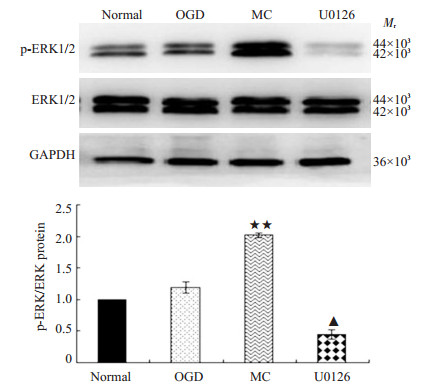
|
图 2 米诺环素对PC12细胞OGD损伤后p-ERK1/2蛋白表达的影响 Figure 2 Effects of minocycline on p-ERK1/2 protein expression in PC12 cells after OGD injury. ★ ★P < 0.05 vs OGD group; ▲P < 0.05 vs MC group. |
本研究进一步探讨ERK1/2信号通路是否参与米诺环素对OGD损伤后PC12细胞HO-1蛋白表达的调控,米诺环素(1 μmol/L)可引起OGD损伤后PC12细胞HO-1蛋白的表达明显升高(P < 0.05),预加U0126干预后,能抵消米诺环素诱导OGD后PC12细胞HO-1表达的上调(P < 0.05),而单独给予U0126预处理后,HO-1的表达无明显变化(P > 0.05,图 3)。
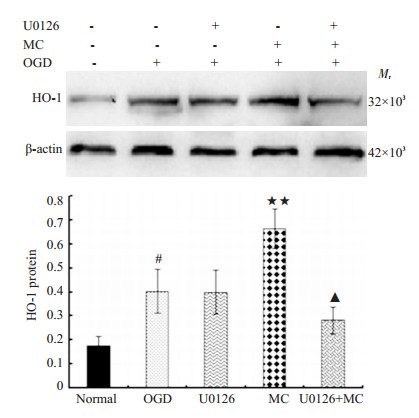
|
图 3 ERK1/2抑制剂对OGD损伤后PC12细胞HO-1蛋白表达的影响 Figure 3 Effects of ERK1/2 inhibitor on HO-1 protein expression in PC12 cells after OGD injury. |
本研究首先证实米诺环素可使OGD损伤后的PC12细胞存活率升高,促进血红素加氧酶-1蛋白表达的增加,进一步研究发现米诺环素诱导OGD损伤后PC12细胞HO-1蛋白表达增加是通过调节ERK1/2信号通路实现。目前的研究表明具有抗氧化活性的HO-1蛋白在缺血再灌注损伤病理过程中发挥着重要的作用[4]。因此,上调HO-1蛋白的表达可能是潜在缺血性脑损伤的治疗新策略。
以前的研究表明米诺环素在体外OGD损伤模型中具有保护作用[5-6]。米诺环素能下调诱导型一氧化氮合酶(iNOS)并上调内皮型一氧化氮合酶(eNOS)的表达,对慢性脑缺血引起的氧化应激损伤具有抑制作用[7]。HO-1是一种重要的内源性抗氧化应激蛋白。Wang等[8]研究表明米诺环素能调节HO-1的表达,减轻急性肝衰竭大鼠氧化应激反应造成的脑损伤。前期研究证实缺血性脑损伤后大鼠脑组织内HO-1的表达明显增加,从而增加脑组织对缺氧的耐受性,抵抗进一步的缺血再灌注损伤[9-10]。首先本研究发现氧糖剥夺后PC12细胞HO-1表达显著增加与前期报道相吻合,提示氧糖剥夺诱导HO-1表达的上调可能是细胞对氧化应激损伤的适应过程。其次本研究观察到米诺环素能提高氧糖剥夺后PC12细胞的存活率,同前期研究结果一致[5]。HO-1基因的转录和表达与细胞外信号调节激酶信号通路的激活有关[11]。脑缺血损伤后,ERK1/2信号通路介导神经元的死亡和存活[6]。许多神经保护剂发挥抗炎、抗氧化应激的作用是通过激活ERK1/2信号通路实现的。Chen等[12]采用原代培养的神经元研究发现,OGD损伤后ERK1/2的磷酸化水平呈动态变化过程,缺氧3 h开始上升一直维持到缺氧12 h。本研究表明PC12细胞OGD损伤/复氧24 h后,ERK1/2的磷酸化水平无明显变化,但PC12氧糖剥夺损伤后米诺环素能激活ERK1/2信号通路,使ERK1/2磷酸化水平增加并上调HO-1的表达,预先加用ERK1/2上游激酶MEK1/2特异性抑制剂U0126可显著抑制HO-1表达的增加。综上,ERK1/2信号通路介导米诺环素诱导OGD损伤后PC12细胞表达HO-1,但本研究尚不能证明OGD损伤后ERK1/2信号通路是否参与HO-1蛋白的表达,而且米诺环素调节ERK1/2磷酸化的机制需进一步研究。米诺环素因具有直接的抗氧化活性,在多种中枢神经系统疾病模型中发挥神经保护作用。因此,米诺环素诱导HO-1的表达和抑制OGD诱导PC12细胞的死亡可能与由其抗氧化活性有关。需要进一步在体内验证这一观点。
综上所述,本研究首先通过体外培养PC12细胞,建立脑缺血再灌注损伤的细胞模型,证明米诺环素对OGD损伤的PC12细胞具有保护作用,其机制可能是通过激活ERK1/2信号通路从而上调抗氧化蛋白HO-1的表达有关。然而,米诺环素的神经保护作用有待动物模型进一步验证。
| [1] | Lampl Y, Boaz M, Gilad R, et al. Minocycline treatment in acute stroke: an open-label, evaluator-blinded study[J]. Neurology,2007, 69 (14) : 1404-10. DOI: 10.1212/01.wnl.0000277487.04281.db. |
| [2] | Chao XD, Ma YH, Luo P, et al. Up-regulation of heme oxygenase-1 attenuates brain damage after cerebral ischemia via simultaneous inhibition of superoxide production and preservation of NO bioavailability[J]. Exp Neurol,2013, 239 : 163-9. DOI: 10.1016/j.expneurol.2012.09.020. |
| [3] | Singh G, Siddiqui MA, Khanna VK, et al. Oxygen glucose deprivation model of cerebral stroke in PC-12 cells: glucose as a limiting factor[J]. Toxicol Mech Methods,2009, 19 (2) : 154-60. DOI: 10.1080/15376510802355216. |
| [4] | 郭筱华, 赵忠新. 血红素加氧酶系统在神经系统疾病中变化的研究进展[J]. 中国临床神经科学,2007, 15 (2) : 212-6. |
| [5] | Song Y, Wei EQ, Zhang WP, et al. Minocycline protects PC12 cells from ischemic-like injury and inhibits 5-lipoxygenase activation[J]. Neuroreport,2004, 15 (14) : 2181-4. DOI: 10.1097/00001756-200410050-00007. |
| [6] | Kikuchi K, Kawahara K, Biswas KK, et al. Minocycline attenuates both OGD-induced HMGB1 release and HMGB1-induced cell death in ischemic neuronal injury in PC12 cells[J]. Biochem Biophys Res Commun,2009, 385 (2) : 132-6. DOI: 10.1016/j.bbrc.2009.04.041. |
| [7] | Cai ZY, Yan Y, Sun SQ, et al. Minocycline attenuates cognitive impairment and restrains oxidative stress in the hippocampus of rats with chronic cerebral hypoperfusion[J]. Neurosci Bull,2008, 24 (5) : 305-13. DOI: 10.1007/s12264-008-0324-y. |
| [8] | Jiang W, Desjardins P, Butterworth RF. Minocycline attenuates oxidative/nitrosative stress and cerebral complications of acute liver failure in rats[J]. Neurochem Int,2009, 55 (7) : 601-5. DOI: 10.1016/j.neuint.2009.06.001. |
| [9] | Peng B, Zhao P, Lu YP, et al. Z-ligustilide activates the Nrf2/HO-1 pathway and protects against cerebral ischemia-reperfusion injury in vivo and in vitro[J]. Brain Res,2013, 1520 : 168-77. DOI: 10.1016/j.brainres.2013.05.009. |
| [10] | Zhang J, Fu B, Zhang X, et al. Bicyclol upregulates transcription factor Nrf2, HO-1 expression and protects rat brains against focal ischemia[J]. Brain Res Bull,2014, 100 : 38-43. DOI: 10.1016/j.brainresbull.2013.11.001. |
| [11] | Wang HQ, Xu YX, Zhu CQ. Upregulation of heme oxygenase-1 by acteoside through ERK and PI3 K/Akt pathway confer neuroprotection against beta-amyloid-induced neurotoxicity[J]. Neurotox Res,2012, 21 (4) : 368-78. DOI: 10.1007/s12640-011-9292-5. |
| [12] | Chen T, Liu W, Chao X, et al. Neuroprotective effect of osthole against Oxygen and glucose deprivation in rat cortical neurons: involvement of mitogen-activated protein kinase pathway[J]. Neuroscience,2011, 183 : 203-11. DOI: 10.1016/j.neuroscience.2011.03.038. |
 2015, Vol. 35
2015, Vol. 35
