2. 重庆市疾病预防控制中心,重庆 400042 ;
3. 第三军医大学劳动 卫生学教研室,重庆 400038
2. Chongqing Center for Disease Control and Prevention, Chongqing 400042, China ;
3. Department of Occupational Health, Third Military Medical University, Chongqing 400038, China
三甲基锡(trimethyltin, TMT)是生产塑料稳定剂中伴生的一种副产物,广泛存在于生产和生活中。工业上,TMT主要存在于油漆、塑料等行业;农业上,TMT主要存在于杀虫剂、灭菌剂等。TMT可通过皮肤、黏膜、呼吸道、消化道等途径进入人体,并与血红蛋白有高度亲和力[1],它可以选择性作用于包括海马在内的边缘系统,其中造成神经系统损伤最突出的表现为学习记忆功能障碍[2]。突触囊泡蛋白(synaptophysin, SYP)是位于突触小泡表面及突触前膜含量丰富的膜蛋白[3],其结构含有缝隙样链接,参与包括单胺类、氨基酸类、胆碱能等多种神经递质的释放过程,并可调节突触可塑性[4];因此,SYP与学习记忆功能密切相关[5],但鲜见SYP蛋白表达在TMT致学习记忆功能障碍中的作用研究。芦丁是一种黄酮类化合物,它具有抗炎,抗氧化,清除自由基等生物学活性。文献报道,芦丁可改善TMT致学习记忆功能障碍模型小鼠的空间记忆能力[6]。本文旨在探讨芦丁预处理对TMT致小鼠学习记忆功能障碍的保护作用及可能机制,为TMT的防治提供参考。
1 材料与方法 1.1 主要试剂三甲基锡(TMT货号:146498,美国Sigma);突触囊泡蛋白(SYP Ⅰ抗,货号:ab8049,美国Abcam);β-actinⅠ抗(货号:A2228,美国Sigma);IRDye 800CW驴抗小鼠荧光抗体(绿鼠Ⅱ抗,货号:926-32212,美国LI-COR)等。
1.2 主要仪器Morris水迷宫视频跟踪系统(MT-200,中国成都泰盟);多功能酶标仪(Infinite M200,瑞士Tecan);Odyssey红外荧光6扫描成像系统(9120,美国LI-COR)等。
1.3 实验动物及分组SPF级6~9周龄雄性BALB/c小鼠(第三军医大学实验动物中心提供,生产许可证:SYXK (渝) 2012-0002)。动物饲养温度:21±2 ℃,室内光照12 h(光照时间08:00~20:00),动物进食标准基础饲料,自由饮水。实验开始前于实验室适应性喂养1周。随机分为生理盐水(对照组)、TMT组、TMT+芦丁组、芦丁组,每组各10只,共40只。TMT的剂量参考文献[7]并通过预实验确定为2.25 mg/kg,1次性给药;后两组芦丁预处理1周(1次/d),芦丁的剂量参考相关文献为10 mg/kg [6],各组均腹腔注射给药。
1.4 测试方法 1.4.1 水迷宫实验Morris水迷宫参照文献[7-8]略改:直径120 cm,平台直径10 cm,水温保持24~26 ℃,用奶粉使水变得不透明,平台放在任意象限中央(与内环和外环相切)并在水下1~2 cm。按照小鼠的生活习性,水迷宫测试的时间在16:00~20:00进行。将小鼠放入水迷宫时,小鼠的头朝向水迷宫壁,4个象限的任意一个入水点均可。水迷宫实验前1 d让小鼠在水迷宫中(无平台)自由游1 min/次,共10次,以熟悉水迷宫环境。小鼠最大逃逸潜伏期为60 s,如果在60 s内小鼠没找到并爬上平台,则由实验员用小木棍引领并将其带上平台,并记录时间为60 s,否则记录相应时间x s,每次让小鼠在平台上待15 s。每只小鼠训练的时间间隔为15 min,1 d完成训练共8次[7],每1次实验结束时将小鼠身上的水擦干并让其在取暖器旁取暖。
1.4.2 Western blot检测参考文献[9]的方法略改:水迷宫实验后,断头处死小鼠,在冰上快速取出海马脑组织,提取总蛋白并测其浓度;经10% SDS-PAGE,80 V恒压分离,用湿转系统将目标蛋白转至NC膜上,电转150 mA;转印结束后,用5%脱脂奶粉封闭1 h;用TBST洗膜5 min×1次,孵育SYPⅠ抗(1:1000)置于脱色摇床4 ℃过夜;次日,TBST洗膜5 min×4次,绿鼠Ⅱ抗(1: 5000)室温下避光孵育1 h,TBST洗膜5 min×4次;β-actinⅠ抗体室温1 h,TBST洗膜5 min×4次,绿鼠Ⅱ抗室温1 h,TBST洗膜5 min×4次,Odyssey红外荧光扫描成像系统软件对目标条带荧光光密度比较分析。
1.5 统计学处理采用SPSS18.0统计软件分析数据,计量资料用均数±标准差表示,Morris水迷宫实验逃逸潜伏期和Western blot的结果先行方差齐性检验,组间比较行单因素方差分析(One-way ANOVA),两两比较用SNK法,P < 0.05为差异有统计学意义。
2 结果 2.1 实验动物的基本情况BALB/c小鼠TMT(2.25 mg/kg)腹腔注射后24 h,TMT组进食与饮水量较对照组和芦丁组及TMT+芦丁组减少,身体有轻微的振颤,头部为最;TMT组活动量较其余3组减少,喜欢成对或成团聚集在一起;TMT组小鼠易被激怒,尾部有少许咬痕等。对照组和芦丁组及TMT+芦丁组进食、饮水量及活动量等表现类似,无明显异常表现。
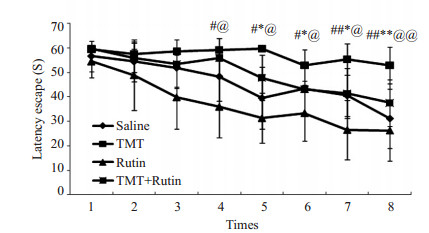
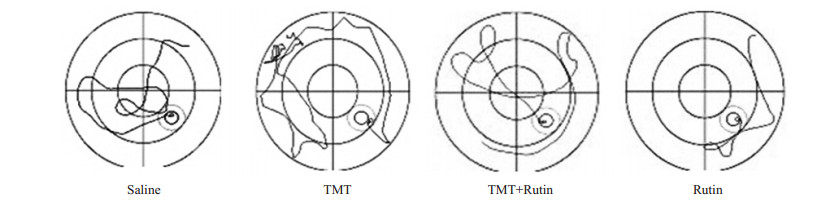
2.2 水迷宫实验TMT(2.25 mg/kg)腹腔注射后24 h,从水迷宫测试的逃逸潜伏期看(图 1),连续8次水迷宫训练,经方差齐性检验,各组总体方差齐同,行单因素方差分析,组间差异有统计学意义(F=8.625,P < 0.01);SNK法比较结果显示:与TMT组相比,生理盐水组(对照)及芦丁组小鼠逃逸潜伏期从水迷宫训练第4次起显著缩短(P < 0.05);与TMT组相比,TMT+芦丁组小鼠逃逸潜伏期从水迷宫训练第5次起显著缩短(P < 0.05);与对照组和芦丁组相比,TMT+芦丁组小鼠逃逸潜伏期差异无统计学意义(P > 0.05)。从搜索平台的策略上看(图 2),TMT组小鼠在水迷宫边缘区域用时较多(外环用时平均占总收索时间的88.91%,中环+内环用时平均占11.9%),主要表现为边缘式;对照组和芦丁组小鼠经水迷宫训练第4次以后搜索平台时多在水迷宫中央区域(外环用时平均占总收索时间为39.10%和36.23%,中环+内环用时平均占60.9%和63.77%),主要表现为趋近式,而TMT+芦丁组小鼠在水迷宫训练到第5次后表现与对照组和芦丁组的搜索方式类似(外环用时平均占总收索时间为43.42%,中环+内环用时平均占56.58%)。
|
图 1 各组连续8次水迷宫训练逃逸潜伏期的结果 Figure 1 Changes in escape latency in each group in consecutive 8 Morris water maze test. TMT groups vs TMT + Rutin groups, *P < 0.05, **P < 0.01; TMT groups vs Saline group, @ < 0.05, @@ < 0.01; TMT groups vs Rutin group, #P < 0.05, ##P < 0.01. |
|
图 2 各组水迷宫训练第8次的轨迹图 Figure 2 Trace diagram in each group in the 8th Morris water maze test. |
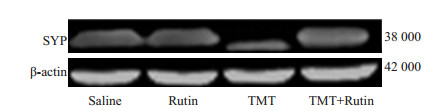
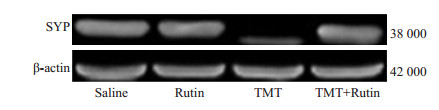
TMT(2.25 mg/kg)腹腔注射后24 h,各组海马和皮层SYP蛋白表达情况(图 3,4)。由表 1可知,经方差齐性检验,各组总体方差齐同;行单因素方差分析显示,组间差异有统计学意义(F=92.168,P < 0.001)。SNK法结果显示:TMT组小鼠海马和皮层脑区SYP蛋白表达较对照组和芦丁组明显降低(P < 0.05);与TMT组相比,TMT+芦丁组小鼠海马和皮层脑区SYP蛋白表达显著增加(P < 0.05);与对照组及芦丁组相比,TMT+芦丁组小鼠海马和皮层脑区SYP蛋白表达差异无统计学意义(P > 0.05)。
|
图 3 Western blot检测各组海马脑区SYP蛋白表达的情况 Figure 3 Expression of synaptophysin protein in the hippocampus in each group detected by Western blotting. |
|
图 4 Western blot检测各组皮层脑区SYP蛋白表达的情况 Figure 4 Expression of synaptophysin protein in the cortex in each group detected by Western blotting. |
| 表 1 Western blot检测各组海马和皮层到SYP蛋白表达 Table 1 Synaptophysin expression in the hippocampus and cortex in each group detected by Western blotting (n=6) |
随着科技的迅猛发展,人们环保意识不断增强,无铅塑料稳定剂逐渐退出市场,含锡稳定剂透明效果及稳定性较好,其占市场份额越来越大。但生产含锡稳定剂如二甲基锡、三乙基锡等过程中会产生一种副产物即TMT。1978年,两位化学家因暴露TMT与DMT的混合物后,表现出一系列中枢神经系统中毒症状[10];以及在生活中不断发生TMT中毒事件,多为急性中毒,并且目前还没有针对TMT中毒的特效解毒剂,从而引起学者们的广泛关注[11]。当前,有人认为TMT可能与神经退行性疾病发生有关[12]。神经退行性疾病突出的表现为学习记忆功能障碍,其确切机制尚未明了。因此,本研究建立急性TMT暴露模型,探讨TMT致学习记忆功能的影响及与学习记忆功能密切相关的SYP蛋白表达情况,并研究芦丁预处理后TMT致小鼠学习记忆功能的影响及SYP蛋白的表达情况,从行为学及分子生物学层面探讨TMT致学习记忆功能障碍的可能机制,为TMT中毒的有效防治提供科学依据。
小鼠TMT(2.25 mg/kg)暴露后24 h,其行为方面表现出有轻微的神经中毒症状,这与前期报道一致[1, 7],而芦丁预处理1周后再给予TMT,小鼠无明显异常表现,提示芦丁预处理可能有预防作用。水迷宫试验作为公认的行为学评价工具,广泛应用于行为、认知功能等方面的研究,因研究对象及建立模型的差异,其训练方式也有所不同。文献报道TMT暴露后其逃逸潜伏期在168 h内可恢复至正常,但其组织损伤尚未修复,因此本研究参考文献在1 d内完成水迷宫测试[7]。经水迷宫测试,TMT组小鼠较对照组小鼠逃逸潜伏期显著延长,并且其搜索策略为边缘式,而TMT+芦丁组和对照组及芦丁组小鼠在水迷宫训练第5次后表现类似,搜索策略为趋近式,这提示TMT急性暴露已导致小鼠学习记忆功能障碍。TMT+芦丁组较TMT组小鼠水迷宫逃逸潜伏期显著缩短,搜索策略也更为科学;TMT+芦丁组与对照组及芦丁组相比,其逃逸潜伏期差异无统计学意义,搜索策略类似,这提示芦丁预处理对TMT致小鼠学习记忆功能障碍有改善作用,这与文献[6]一致。
小鼠TMT(2.25 mg/kg)暴露后24 h,Western结果显示TMT组小鼠海马和皮层脑区SYP蛋白表达较对照组显著降低;结合水迷宫测试,TMT组小鼠逃逸潜伏期较对照组显著延长。芦丁预处理1周再给予TMT,结果提示芦丁预处理可拮抗TMT致小鼠海马和皮层脑区SYP蛋白表达降低;TMT+芦丁组小鼠较对照组和芦丁组小鼠海马和皮层脑区SYP蛋白表达略为降低,但差异无统计学意义;经水迷宫测试,芦丁预处理可改善TMT致小鼠逃逸潜伏期显著延长的情况,并且与对照组及芦丁组小鼠逃逸潜伏期差异无统计学意义,这提示芦丁对TMT致小鼠学习记忆功能障碍的保护作用与拮抗海马和皮层脑区SYP蛋白表达下调有关。文献报道SYP广泛表达于突触前膜和突触小泡[13],因其特殊结构,可通过胞吞或胞吐等方式参与神经递质的释放过程[14],并可调节突触可塑性[4];因此,SYP表达含量变化与学习记忆功能密切相关[15-16]。目前,关于TMT导致学习记忆功能障碍发生的机制研究主要有凋亡、炎性反应、氧化损伤、钙离子通道、神经递质释放[17-19]等,涉及多条信号通路[20],但TMT是如何导致海马和皮层等脑区SYP蛋白含量降低,而引起学习记忆功能障碍的发生,其确切机制有待进一步研究。
| [1] | Brown AW, Aldridge WN, Street BW, et al. The behavioral and neuropathologic sequelae of intoxication by trimethyltin compounds in the rat[J]. Am J Pathol,1979, 97 (1) : 59-82. |
| [2] | Earley B, Burke M, Behavioral LB. Biochemical and histological effects of trimethyltin (TMT) induced brain damage in the rat[J]. Neurochem Int,1992, 21 (3) : 351-66. DOI: 10.1016/0197-0186(92)90186-U. |
| [3] | Wiedenmann B FW, Localization OS. An integral membrane glycoprotein of Mr 38 000 characteristic of presynaptic vesicles[J]. Cell,1985, 41 (3) : 1017-28. DOI: 10.1016/S0092-8674(85)80082-9. |
| [4] | Kwon SE, Chapman ER. Synaptophysin regulates the kinetics of synaptic vesicle endocytosis in central neurons[J]. Neuron,2011, 70 (5) : 847-54. DOI: 10.1016/j.neuron.2011.04.001. |
| [5] | Hayashi ML, Choi SY, Rao BS, et al. Altered cortical synaptic morphology and impaired memory consolidation in forebrainspecific dominant-negative PAK transgenic mice[J]. Neuron,2004, 42 (5) : 773-87. DOI: 10.1016/j.neuron.2004.05.003. |
| [6] | Koda T, Kuroda Y, Imai H. Protective effect of rutin against spatial memory impairment induced by trimethyltin in rats[J]. Nutrition Research,2008, 28 (9) : 629-34. DOI: 10.1016/j.nutres.2008.06.004. |
| [7] | Halladay AK, Wilson DT, Wagner GC, et al. Trimethyltin-induced alterations in behavior are linked to changes in PSA-NCAM expression[J]. Neurotoxicology,2006, 27 (2) : 137-46. DOI: 10.1016/j.neuro.2005.06.005. |
| [8] | Kee N, Teixeira CM, Wang AH, et al. Preferential incorporation of adult-generated granule cells into spatial memory networks in the dentate gyrus[J]. Nat Neurosci,2007, 10 (3) : 355-62. DOI: 10.1038/nn1847. |
| [9] | Zc X, ChenYM, Xu P, et al. Epileptiform discharge upregulates p-ERK1/2, growth-associated protein 43 and synaptophysin in cultured rat hippocampal neurons[J]. Seizure,2009, 18 (10) : 680-5. DOI: 10.1016/j.seizure.2009.09.004. |
| [10] | Fortemps E, Amand G, Bomboir A, et al. Trimethyltin poisoning. Report of two cases[J]. Int Arch Occup Environ Health,1978, 41 : 1-6. DOI: 10.1007/BF00377794. |
| [11] | Tang X, Yang X, Lai G, et al. Mechanism underlying hypokalemia induced by trimethyltin chloride: Inhibition of H +/K +-ATPase in renal intercalated cells[J]. Toxicology,2010, 271 (1/2) : 45-50. |
| [12] | Corvino V, Marchese E, Michetti F, et al. Neuroprotective strategies in hippocampal neurodegeneration induced by the neurotoxicant trimethyltin[J]. Neurochem Res,2013, 38 (2) : 240-53. DOI: 10.1007/s11064-012-0932-9. |
| [13] | Rustom A, Saffrich R, Markovic I, et al. Nanotubular highways for intercellular organelle transport[J]. Science,2004, 303 (5660) : 1007-10. DOI: 10.1126/science.1093133. |
| [14] | Stevens RJ, Akbergenova Y, Jorquera RA, et al. Abnormal synaptic vesicle biogenesis in Drosophila synaptogyrin mutants[J]. J Neurosci,2012, 32 (50) : 18054-67. DOI: 10.1523/JNEUROSCI.2668-12.2012. |
| [15] | Ya BL, Liu WY, Ge F, et al. Dietary cholesterol alters memory and synaptic structural plasticity in young rat brain[J]. Neurol Sci,2013, 34 (8) : 1355-65. DOI: 10.1007/s10072-012-1241-4. |
| [16] | Parihar VK, Limoli CL. Cranial irradiation compromises neuronal architecture in the hippocampus[J]. Proc Natl Acad Sci USA,2013, 110 (31) : 12822-7. DOI: 10.1073/pnas.1307301110. |
| [17] | Ravanan P, Harry GJ, Awada R, et al. Exposure to an organometal compound stimulates adipokine and cytokine expression in white adipose tissue[J]. Cytokine,2011, 53 (3) : 355-62. DOI: 10.1016/j.cyto.2010.11.015. |
| [18] | Qu M, Zhou Z, Chen C, et al. Lycopene protects against trimethyltin-induced neurotoxicity in primary cultured rat hippocampal neurons by inhibiting the mitochondrial apoptotic pathway[J]. Neurochem Int,2011, 59 (8) : 1095-103. DOI: 10.1016/j.neuint.2011.10.005. |
| [19] | Fabrizi C, De Vito S, Somma F, et al. Lithium improves survival of PC12 pheochromocytoma cells in high-density cultures and after exposure to toxic compounds[J]. Int J Cell Biol,2014, 2014 : 135908. DOI: 10.1155/2014/135908. |
| [20] | Kim BK, Tran HY, Shin EJ, et al. IL-6 attenuates trimethyltininduced cognitive dysfunction via activation of JAK2/STAT3, M1 mAChR and ERK signaling network[J]. Cell Signal,2013, 25 (6) : 1348-60. DOI: 10.1016/j.cellsig.2013.02.017. |
 2015, Vol. 35
2015, Vol. 35