2. 南京中医药大学药学院,江苏 南京 210029 ;
3. 南京中医药大学附属医院临床药理科,江苏 南京 210029 ;
4. 南京军区总医院临床药理科,江苏 南京 210002
2. College of Pharmacy, Nanjing University of Traditional Chinese Medicine, Nanjing 210029, China ;
3. Department of Clinical Pharmacology, Affiliated Hospital of Nanjing University of Traditional Chinese Medicine, Nanjing 210029, China ;
4. Department of Clinical Pharmacology, General Hospital of Nanjing Military Command, Nanjing 210002, China
氯吡格雷具显著的抗血小板聚集药效,临床上常用于防治心脑血管疾病,效果显著,作用机制清楚[1]。但该药物在临床使用过程中,约5%~40%人群在服药后反应低,甚至无反应,有心血管临床事件发生,产生抵抗现象[2]。在应对氯吡格雷抵抗处置中,常选择复方丹参滴丸(片)、血塞通注射液(片剂)等中药制剂联用策略,在临床上取得了显著地成效,具体机制不清楚[3-5]。
目前有关于中西药协同效应的研究主要集中在单成分的药效-药动方面[6-7],而对中药活性组分协同作用研究较少,血浆蛋白结合率为药代动力学重要参数之一,对血浆蛋白结合率的协同作用可以影响到药物游离体的血浆浓度,从而间接影响到药效-药代作用特征[8]。复方丹参滴丸(片)、血塞通注射液(片剂)等中药制剂中,均含有人参皂苷活性组分,且相关研究表明人参皂苷Rg1、Rb1为上述制剂抗血小板聚集活性组分,故研究氯吡格雷-人参皂苷血浆蛋白结合率协同效应,可间接表征中西药协同效应的药效-药动学特征,并为临床用药提供参考和启示。
参照本实验室确立的血浆蛋白结合率步骤[10],首先建立了皂苷Rg1、Rb1的液相色谱质谱联用(LC-MS)含量检定方法,采用平衡透析法揭示了氯吡格雷对Rg1、Rb1血清蛋白结合率影响;接下来,采用同源模建方法建构RSA三维构造,并用分子模拟方法揭示各化合物与RSA间结合效应,揭示氯吡格雷-人参皂苷在血浆蛋白结合率层面协同效应,为相关药物的联用提供理论支持。
1 实验材料 1.1 药品与试剂标准品硫酸氢氯吡格雷(批号100819-201102)、人参皂苷Rg1(批号110703-201128)、Rb1(批号110704-201223),购于中国食品药品检定研究院;甲醇、乙腈:色谱纯,Merck Company;磷酸(批号J1321063):色谱纯,Aladdin;透析袋MD25:8000~14400 D,BIOSHARP公司。
1.2 仪器及色谱条件安捷伦1290HPLC、6430 LC-MS质谱仪,配电喷雾化离子源(ESI)及工作站MassHunter;Micro-17R冷冻离心机:美国Thermo。
1.3 大鼠血浆SPF级SD大鼠20只,许可证号:SCXK(苏)2009-0001,眼眶取血离心,取上清液冻存即得。
2 实验方法 2.1 LC-MS条件安捷伦ZOBAX SB C18色谱柱(2.1 mm×150 mm,5 μm);流动相:甲醇-0.1%甲酸水溶液(15:85);流速:200 μl·min-1;柱温:25 ℃;进样量:2 μl;正离子化模式,多反应监测模式(MRM)定量;干燥气温度:400 ℃;毛细管电压:4000 V;Rg1、Rb1碰撞及毛细管电压值分别为100、10和100、20 V。
2.2 平衡透析实验方法对半透膜袋进行相关前处理,将1 ml空白大鼠血清加入到洁净透析袋内,密封,浮悬于含30 ml不同浓度药物(皂苷Rg1、Rb1)PBS透析外液溶液中,外液PBS中人参皂苷Rg1、Rb1质量浓度分别为0.4、1.0、2.0 mg·L-1,置于4 ℃下进行透析实验中,实验结束后用10%高氯酸溶液检定,每个样品重复6次。
2.3 内液血样处理采用溶剂沉淀法,精密吸取透析结束后内液样品100 μl到1.5 ml离心管中,涡30 s,加300 μl丙酮-乙腈(1:3,V/V),涡旋4 min混匀,12 000 r/min离心5 min,取上清液再次离心5 min;取上清液250 μl,45 ℃离心浓缩仪旋转吹干,加100 μl 10%甲醇复溶,12 000 r/min离心5 min,取上清液进样分析。
2.4 氯吡格雷对血浆蛋白结合率影响按照上述2.2方法,各透析外液中加入适量氯吡格雷使得其质量浓度为1.0 mg·L-1,研究揭示该浓度氯吡格雷对人参皂苷0.4、1.0、2.0 mg·L-1浓度下血浆蛋白结合率作用特征。
2.5 数据处理采用BAPP 2.3对Rg1、Rb1峰面积-浓度(透析内液、外液)的标准曲线进行拟合;采用SPSS(19.0)配对样本t-检验统计分析比较。
3 结果和讨论 3.1 LC-MS图在本实验色谱条件下,皂苷Rg1、Rb1保留时间分别为1.2、1.6 min,各峰峰形良好,基线平稳(图 1)。
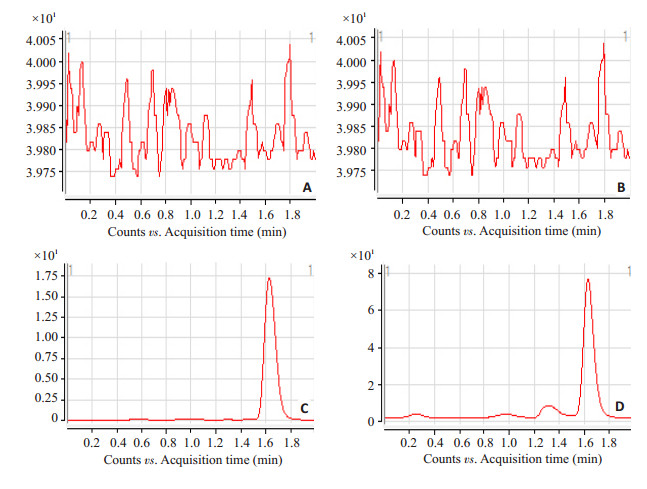
|
图 1 人参皂苷Rg1、Rb1的MRM色谱图 Figure 1 MRM chromatograph of ginsenosides Rg1 (left) and Rb1 (right). A: PBS; B: Rat plasma; C: PBS containing Rg1 (or Rb1); D: Rat plasma containing Rg1 (or Rb1). |
方法学考查如线性及范围、准确度、精密度等参照文献方法,通过分析物峰面积Y与样品浓度X进行回归分析,得人参皂苷Rg1在透析外液标线方程为Y=50802X+1564.25,相关系数R2=0.9881,在透析内液标线方程为Y=68464.29X + 2846.27,相关系数R2=0.9882;人参皂苷Rb1在透析外液标线方程为Y=22875.65X+3127.22,相关系数R2=0.9887,在透析内液标线方程为Y=31758.27X + 2811.13,相关系数R2=0.9876,线性范围均为10.00~3000 μg·L-1。
3.3 精密度、准确度分析物的精密度、准确度详见表 1。
| 表 1 人参皂苷Rg1、Rb1的精密度与准确度 Table 1 Detection precision and accuracy of ginsenosides Rg1 and Rb1 (Mean±SD) |
人参皂苷Rg1、Rb1在0.4、1.0、2.0 mg·L-1三种浓度下回收率分别为(92.16±2.32)%、(90.34±3.25)%、(88.14±3.52)%和(90.45±4.23)%、(87.23±3.12)%、(93.12±1.33)%,均在85%以上,稳定性结果表明人参皂苷Rg1、Rb1在-20 ℃冻藏14 d、前处理后4 ℃条件下放置24 h、室温放置5 h均保持稳定,但需要避光处理。
3.5 平衡时间、透析膜吸附参考文献方法进行考查,结果显示人参皂苷Rg1、Rb1可在48 h内透析平衡;0.4、1.0、2.0三种浓度下透析膜对人参皂苷Rg1、Rb1吸附率分别为4.35±1.23、3.21±0.34、5.52±0.92和1.23±1.04、3.25±2.13、4.62±2.19,表明透析膜对人参皂苷Rg1、Rb1存在微弱吸附,对结果无影响。
3.6 血清蛋白结合率通过比较加入或不加氯吡格雷时人参皂苷Rg1、Rb1在0.4、1.0、2.0三种浓度下血浆蛋白结合率的差异,结果见表 2,结果表明Rb1血浆蛋白结合率高于Rg1,合并加入氯吡格雷后血浆蛋白结合率均呈下降趋势,说明氯吡格雷与人参皂苷在血浆蛋白结合率存在竞争效应。
| 表 2 氯吡格雷对人参皂苷血浆蛋白结合率的影响 Table 2 Effect of clopidogrel on plasma protein binding rate of ginsenosides |
考虑到目前尚无法通过X-射线实验方法解析出大鼠血清白蛋白(RSA)立体晶体构造,以RSA一级氨基酸序列(P02770)为研究对象,在NCBI序列比对方法选择同源模建模板,选择了家兔血清白蛋白(4F5V蛋白A链),RSA与模板序列间同一性为73%,阳性率为86%,间隔为0%,符合同源模建要求。
选用Maestro Prime工具构建蛋白,选用ERRAT、PRO-CHECK工具进行评价(表 3),仅有56、109、130、322、562等30个残基(RSA共608个)在不合理区区域,距离蛋白活性口袋较远,说明构建的蛋白结构合理可靠。
| 表 3 同源模建蛋白及模板蛋白评价 Table 3 Validation with the protein model and RSA by ERRAT and PRO-CHECK toolsools |
选用Glide模块研究氯吡格雷、皂苷Rg1、Rb1与大鼠血清蛋白的结合模式(图 2),氯吡格雷、皂苷Rg1、Rb1对接得分分别为-8.452、-2.342、-4.236,其中氯吡格雷与RSA的结合力主要为疏水作用,皂苷Rg1、Rb1糖链上羟基与RSA的Arg257、Arg222形成两个氢键,以上结果表表明两个化合物与大鼠血清白蛋白均有一定程度的结合效应,其中氯吡格雷的结合效应明显高于皂苷Rg1、Rb1,两个化合物之间存在竞争结合效应,氯吡格雷的存在可明显降低皂苷Rg1、Rb1的血浆蛋白结合率,以上结合与平衡透析法实验结果相一致,这在一定程度上证明了我们实验方法的可行性和可靠性(图 2)。
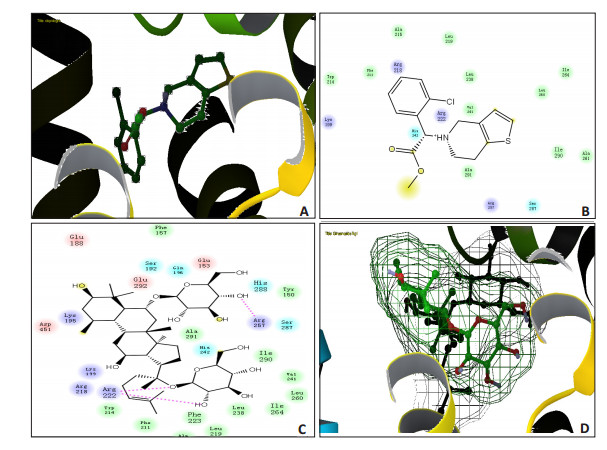
|
图 2 皂苷Rg1、氯吡格雷与大鼠血清白蛋白结合模式图 Figure 2 Binding site of Rat serum albumin with ginsenosides and clopidogrel. In Fig A and D, the stick shape represents small molecular compounds, the grid line the molecular surface, and the ribbon rat serum albumin protein. Pink dotted lines represent hydrogen bonds. A: Binding model of clopidogrel and RSA; B: Amino acid residues binding with clopidogrel; C, D: Amino acid residues binding with ginsenosides Rg1 and Rg1, respectively. |
目前有关于中西药协同作用特征,目前主要有药效-药动两部分[8-9],血浆蛋白结合率为药动学重要组成部分,血浆蛋白协同作用可使得药物血药浓度发生变化[10],进而影响到药效-药动层面。
本实验采用LC-MS平衡透析法和分子模拟两种不同的方法揭示了氯吡格雷-人参皂苷血浆蛋白结合率协同作用特征。结果表明皂苷Rg1血浆蛋白结合率比Rb1低,其原因可能是两个化合物相对分子质量及空间位阻引起,合并加入氯吡格雷后使得三个浓度下均血浆蛋白结合率下降10%,从而使得人参皂苷游离血药浓度增加[3-5],而临床研究表明氯吡格雷与含有人参皂苷Rg1、Rb1中药联用时药效增强。由于人参皂苷具有显著的抗血小板聚集活性[6],推测在联用过程中氯吡格雷合并加入使得中药制剂活性组分人参皂苷血浆蛋白结合率下降,游离皂苷血药浓度增加,药动-药效学行为发生改变,而发挥抗血小板聚集协同增效作用。本研究为临床上氯吡格雷与含人参皂苷类制剂联合应用提供一定的参考和理论支持。
| [1] | 高燕, 卢学春, 曹剑, 等. 老年冠心病患者氯吡格雷联用钙拮抗剂的疗效观察:一项基于倾向评分的回顾性队列研究[J]. 南方医科大学学报,2012, 32 (4) : 462-6. |
| [2] | Karazniewicz-Lada M, Danielak D, Burchardt PA, et al. Clinical pharmacokinetics of clopidogrel and its metabolites in patients with cardiovascular diseases[J]. Clin Pharmacokinet,2014, 53 (2) : 155-64. DOI: 10.1007/s40262-013-0105-2. |
| [3] | 蔡洪滨, 姚朱华, 高仪. 复方丹参滴丸联合氯吡格雷片对不稳定型心绞痛患者血小板功能的影响[J]. 中医杂志,2013, 54 (6) : 500-2. |
| [4] | 孟康, 朱华刚, 宋现涛, 等. 三七总皂苷联合双重抗血小板药物治疗对冠状动脉支架术后患者心血管事件的影响[J]. 中国医药,2013, 8 (4) : 445-7. |
| [5] | 李勤劳. 血塞通注射液对人体血小板聚集调节作用的实验研究[J]. 陕西中医,2010, 31 (8) : 1062-3. |
| [6] | 周于禄, 曾嵘. 银杏叶提取物对华法林人体内抗凝血功能和血药浓度的影响[J]. 中国中药杂志,2011, 36 (16) : 2290-3. |
| [7] | 周盼盼, 王彦刚. 基于中药药效-药动学的中医药方证相应理论的研究进展[J]. 中草药,2013, 44 (22) : 3236-40. |
| [8] | 吴雅卿, 钱隽, 朱建华, 等. 游离125I与血浆蛋白的结合及其对血药浓度测定的影响[J]. 高等学校化学学报,2008, 29 (10) : 1959-62. |
| [9] | 华声瑜, 曲凤, 陈丽平, 等. 皂苷Rg1, Rb1对血小板聚集及环磷腺苷的影响[J]. 天津中医药大学学报,2012, 31 (1) : 31-3. |
| [10] | 程小桂, 居文政, 戴国梁, 等. 平衡透析法测定人体外血浆中原花青素B2, 表儿茶素蛋白结合率[J]. 中国药理学通报,2013, 29 (10) : 1465-7. |
 2015, Vol. 35
2015, Vol. 35
