2. 上海中医药大学穆拉德中药现代化研究中心,上海 201203 ;
3. 上海交通大学医学院附属第三人民医院中医科,上海 201999 ;
4. 美国乔治华盛顿大学生物化学与分子医学系,美国 华 盛顿 20052
2. Murad Research Institute for Modernized Chinese Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China ;
3. Shanghai Third People's Hospital, School of Medicine, Shanghai Jiaotong University, Shanghai 201999, China ;
4. Department of Biochemistry and Molecular Medicine, George Washington University, Washington DC 20052, USA
脂肪前体细胞是一类具有增殖和向脂肪细胞分化的特异化前体细胞。因为具有脂肪细胞的分化能力而被广泛应用于糖、脂代谢相关的基础和实验研究,应用脂肪前体细胞建立的体外IR模型已被广泛应用于胰岛素增敏剂药物作用的评价和研究。国外已建立了来源于小鼠的前体脂肪细胞株,如3T3-L1,3T3-F442A,ob17等系列,并已应用于医学研究的各个领域。其中3T3-L1细胞株的应用最为广泛。3T3-L1前体脂肪细胞分裂自Swiss小鼠的脂肪纤维细胞,3T3-L1前体脂肪细胞是由Green和Kehinde分离克隆的,在细胞融合成单层的情况下具有自发的分化为成熟脂肪细胞的能力,但这种分化方式效率很低,且耗时。国内外研究多采用1-甲基-3-异丁基黄嘌呤(3-isobutyl-methylxanthine, IBMX)、地塞米松(dexamethason, DEX)、胰岛素共同作用来进行诱导分化[1-3]。但是,到底使用多大浓度的胰岛素?不同的文献有不同的报道。诱导的时间是多少?诱导成功后的脂肪胰岛素抵抗(insulin resistance, IR)细胞稳定性怎么样?国内外文献并未见详细报道。基于此,本实验着重考察了3T3-L1前脂肪细胞诱导分化成脂肪细胞各个不同因素,以及将3T3-L1脂肪细胞诱导成胰岛素抵抗脂肪细胞的最佳胰岛素浓度、诱导时间和IR-3T3-L1细胞稳定时间,摸索出该模型的最佳诱导条件。
1 材料和方法 1.1 细胞3T3-L1前脂肪细胞株(中国科学院上海生命科学研究院细胞资源中心)。
1.2 仪器TRUE-100纯水仪(上海菲特科学器材有限公司,序列号:081230-62)、CO2细胞培养箱(HEPA CLASS 100)、倒置相差显微镜(IX 71,Olympus)、SIM-F140AY65 SANYO制冰机(日本三洋)、-80 ℃超低温冰箱(Forma-86 C,美国Thermo)、METTLER TOLEDO MS105型电子精密天平[梅特勒-拖利多仪器(上海)有限公司]、IX71SF-2倒置显微镜(Olympus)等。
1.3 试剂IBMX、DEX、Oil red O及牛胰岛素购自Sigma,DMEM培养基、0.25%胰蛋白酶及新生牛血清购自GIBCO,青链霉素混合液(中国杭州四季青)、葡萄糖氧化酶法-过氧化物酶法测定试剂盒(上海荣盛生物药业有限公司)、无水乙醇、甲醛、异丙醇、NaHCO3、NaOH、HCl等均购自中国医药集团上海化学试剂公司。
1.4 3T3-L1前脂肪细胞的培养将存放于液氮中的细胞取出快速放入37 ℃水浴锅内解冻,将冻存管内地细胞吸出放入离心管中离心(1000 r·min-1)5 min,弃去上清液后将3T3-L1前脂肪细胞放于10% FBS的高糖DMEM细胞维持培养基中,于37 ℃,5% CO2培养箱培养,隔天再更换新的培养基,以利于细胞生长。3T3-L1前脂肪细胞株以倒置显微镜观察,当细胞长满为培养皿的80%左右时,可进行传代培养,在超净台内,吸去上层培养基,以4 ml PBS洗两次,吸去PBS并加入1 ml胰蛋白酶,前后左右轻晃,以使胰蛋白酶均匀分散于细胞层,置于培养箱中约2~3 min后,细胞层脱落并浮起时,加入2 ml含有10% FBS的高糖DMEM培养基以终止胰蛋白酶反应,再加入3 ml PBS微微冲洗多次,以冲散细胞后吸入无菌离心管,经800 r·min-1,离心3 min后弃去上层液。
1.5 3T3-L1前脂肪细胞诱导成脂肪细胞将悬浮的细胞计数,以1×106 ml-1培养于24孔板(DMEM细胞维持培养基),待细胞长满后再继续培养2天,更换培养基为含有不同浓度胰岛素的分化起始培养基(Group 1: DMEM+10% FBS+1 μmol·L-1 DEX +0.5 mmol·L-1 IBMX+10-8 mol·L-1 Insulin; Group 2: DMEM + 10% FBS + 1 μmol·L-1 DEX + 0.5 mmol·L-1 IBMX + 10-7 mol·L-1 Insulin; Group 3: DMEM + 10% FBS+1 μmol·L-1 DEX+0.5 mmol·L-1 IBMX+10-6 mol·L-1 Insulin) 2 ml做分化诱导,并记为分化第0天。诱导分化2 d后,更换培养基为含有胰岛素分化培养基(Group 1: DMEM + 10% FBS + 10-8 mol·L-1 Insulin; Group 2: DMEM + 10% FBS + 10-7 mol · L-1 Insulin; Group 3: DMEM+10% FBS+10-6 mol·L-1 Insulin),培养于37 ℃、5% CO2恒温培养箱中(表 1)。
| 表 1 3T3-L1细胞分组 Table 1 3T3-L1 differentiation-inducing process |
每3 d更换培养基1次。分别取分化第3、6、9天的细胞,以Oil Red O染色以鉴定3T3-L1分化程度,观察在何种胰岛素浓度下,3T3-L1有最佳的分化条件。
1.6 Oil Red O染色鉴定为了确认前脂肪细胞是否已经成功诱导成脂肪细胞,且诱导率是多少,需要利用Oil Red O对其进行染色确认。参考文献[4-5],按如下步骤进行:吸去3T3-L1脂肪细胞培养基→以PBS清洗培养皿2次→加入甲醛固定液→静置10 min→到去甲醛固定液→以清水清洗1次→加入100% propylene glycol→静置2 min→到去100% propylene glycol→加入Oil Red O染料→染色10 min→到去Oil Red O染料→加入100% propylene glycol→1 min→到去100% propylene glycol,去除多余的染料→清水轻轻润洗3次→苏木精染料→染色2 min→水洗5 min→显微镜下观察,拍照。
1.7 IR-3T3-L1脂肪细胞的建立 1.7.1 最佳诱导时间的确立参考文献[6-8],将分化成功的3T3-L1脂肪细胞接种入24孔板,分为对照组(control)和模型组(10-6 mol·L-1 insulin),对照组加正常培养基,模型组加入含1 μmol·L-1 DEX的培养基,用GOD-POD法检测24、48、72、96、120 h培养基上清液中的葡萄糖量,选择正常组和模型组细胞葡萄糖消耗最大的时间为诱导最佳时间。实验重复3次。
1.7.2 IR-3T3-L1的稳定性将建立好的IR-3T3-L1细胞(模型组)和分化好的3T3-L1细胞(对照组)同时加入正常培养基中(不含DEX),用用GOD-POD法检测24、36、48 h培养基上清液中的葡萄糖量,观察IR-3T3-L1细胞的稳定性。实验重复3次。
1.8 统计及图像分析实验数据采用均数±标准差表示,多组比较分析采用单因素方差分析,所有数据处理均采用GraphPad Prism version 6.01软件(GraphPad Software Inc, San Diego, CA, USA),P < 0.05表示差异有统计学意义,P < 0.01表示差异有显著性意义。
2 结果 2.1 3T3-L1前脂肪细胞的培养分化3T3-L1分化为脂肪细胞条件为DMEM培养基中添加1 μmol·L-1 DEX,0.5 mmol·L-1 IBMX及胰岛素。由于不同文献使用胰岛素的浓度各不相同,从不加胰岛素到加1.7×10-7 mol·L-1再到添加1.7×10-8 mol·L-1,使用范围相差极大。故本实验需要探索胰岛素对脂肪细胞分化的影响。
实验发现,3T3-L1细胞从液氮中的冻存状态复苏后,培养需要传代3次,才能够有良好的增殖速率,每次传代以1:3的比例移植到新皿中,3 d长满80%。3T3-L1前脂肪细胞在诱导前,细胞与成纤维母细胞相似,细胞呈现典型的不规则扁梭形,胞浆中未见脂滴(图 1A),诱导后细胞形态变圆,胞浆亮,脂滴丰富,形成“戒环样”结构,即为典型的成熟脂肪细胞(图 1B)。
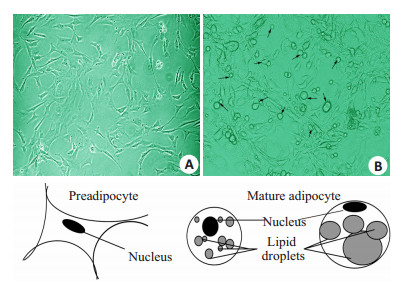
|
图 1 3T3-L1分化前后形态学变化 Figure 1 Morphology of 3T3-L1 cells before and after induced differentiation. A: Untreated; B: After induction, lipid drops formed in the cells (arrow) (Original magnification: ×200). |
添加10-8 mol·L-1、10-7 mol·L-1、10-6 mol·L-1的胰岛素在3T3-L1前脂肪细胞的培养基中,刺激分化3 d,以Oil Red O染色发现油脂堆积不明显(图 2A~C);从第6天开始,发现10-6 mol·L-1胰岛素的分化处理下,相较10-8 mol·L-1、10-7 mol·L-1胰岛素处理组有较佳的分化效果(图 2D~F)。分化处理9日后,不同浓度胰岛素的分化效果有明显区别,分化条件在10-6 mol·L-1胰岛素之下,细胞90%以上转化为脂肪细胞,具有最好的分化效果(图 2G~I),所以在以后的实验中,以3T3-L1脂肪细胞为实验材料时,胰岛素以10-6 mol·L-1浓度作为分化条件。
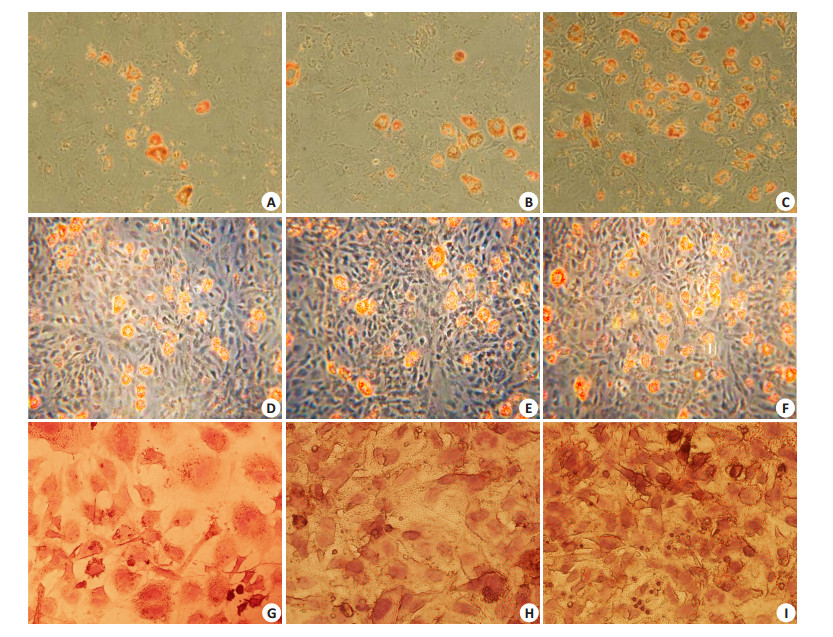
|
图 2 不同浓度胰岛素情况下3T3-L1脂肪细胞分化培养 Figure 2 Effect of insulin on 3T3-L1 preadipocyte differentiation (Original magnification: ×200). 3T3-L1 preadipocytes were induced to differentiation medium with (A) 10-8 mol·L-1 insulin, 3 d; (B) 10-7 mol·L-1 insulin, 3 d; (C) 10-6 mol·L-1 insulin, 3 d; (D) 10-8 mol·L-1 insulin, 6 d; (E) 10-7 mol·L-1 insulin, 6 d; (F) 10-6 mol·L-1 insulin, 6 d; (G) 10-8 mol·L-1 insulin, 9 d; (H) 10-7 mol·L-1 insulin, 9 d and (I) 10-6 mol·L-1 insulin, 9 d. Cells were induced to differentiate for 3 days and stained with Oil red O. |
图 3所示,分化好的3T3-L1细胞在1 μmol·L-1 DEX条件下培养24~96 h,发现随着培养时间的增加,葡萄糖消耗率也逐渐增加,表明细胞胰岛素抵抗越来越明显,当培养96 h后,培养基上清液中的葡萄糖与对照组比较差异有极显著性意义(14.38±0.489 mmol·L-1 vs 11.05±0.386 mmol·L-1,P=0.0003),葡萄糖消耗率也达到最大30.18%(图 3B),此时3T3-L1脂肪细胞胰岛素抵抗状态最明显。培养120 h后,模型组葡萄糖摄取增加,与对照组比较无统计学意义。所以,3T3-L1诱导的最佳时间为96 h。
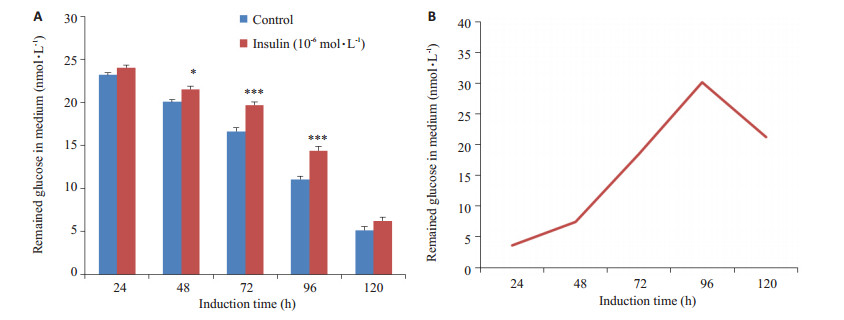
|
图 3 IR-3T3-L1细胞最佳诱导时间的确定 Figure 3 Optimal induction time of IR-3T3-L1 cells. A: Effect of treatment time of insulin on insulin-resistance of 3T3-L1 cell; B: Glucose consumption rate of IR-3T3-L1 cell at different time points (Mean±SE, n=6). *P < 0.05, **P < 0.01, ***P < 0.001 vs control. |
稳定性试验的目的是考察IR-3T3-L1细胞在本实验的温度、湿度、DEX诱导浓度等影响下随时间变化的规律,为后续实验提供科学依据。由表 2,可见,IR-3T3-L1细胞在正常培养基培养36 h内,上清液中的葡萄糖消耗值与对照组比较均具有显著性差异(P < 0.001)。
| 表 2 IR-3T3-L1细胞稳定时间表 Table 2 The maintaining time of insulin resistant 3T3-L1 cells (Mean±SD, n=6) |
脂肪前体细胞是一类具有增殖和向脂肪细胞分化的特异化前体细胞。应用脂肪前体细胞建立的体外IR模型已被广泛应用于胰岛素增敏剂药物作用的评价和研究[9-11]。国外已经建立了来源于小鼠的脂肪前体细胞株,例如3T3-L1,3T3-F442A,ob17等系列,并且已被应用于医学生物学研究的各个领域。其中3T3-L1细胞株的应用最为广泛。
3T3-L1细胞系是在1974年Green和Kehinde由Swiss mouse embryo的3T3-L1成纤维细胞所分离克隆出来,此细胞具有高度接触抑制性,可由前脂肪细胞转换成脂肪细胞形态。3T3-L1细胞不但在体外经诱导后可以分化为成熟的脂肪细胞,而且植入小鼠体内后也可以分化并形成脂肪团块,且不易与小鼠原有的脂肪细胞区别[12]。能较好地模拟活体脂肪组织的功能,是一种研究脂肪细胞生成作用最常用的细胞株。
Yi等[12]成功以0.5 mmol·L-1软脂酸与25 mmol·L-1的葡萄糖加0.6 nm·L-1的胰岛素诱导3T3-L1脂肪细胞产生胰岛素抵抗。张颖等[13]用游离脂肪酸(FFA)制备了3T3-L1脂肪细胞胰岛素抵抗模型。叶夏云等[14]采用10、100、1000 nmol·L-1的地塞米松建立了3种不同程度的3T3-L1脂肪胰岛素抵抗细胞,发现随着DEX浓度的增加所建立的模型胰岛素抵抗程度也增加,但是没有具体考察IR-3T3-L1模型的稳定时间。
本实验发现,3T3-L1细胞从液氮中的冻存状态复苏后,培养需要传代3次,才能够有良好的增殖速率。诱导成功后的3T3-L1脂肪细胞形态变圆,胞浆亮,脂滴含量丰富,成“戒环状”结构,其外表形态、油滴大小、分布样式均与动物身上的白色脂肪细胞相似。
3T3-L1分化为脂肪细胞条件为DMEM培养基中添加1 μmol·L-1 DEX,0.5 mmol·L-1 IBMX及胰岛素。由于不同文献使用胰岛素的浓度各不相同,从不加胰岛素[15]到加1.7×10-7 mol·L-1 [16],添加1.7×10-6 mol·L-1 [17]再到8.6×10-4 mol·L-1浓度的胰岛素[18],使用范围相差极大。故本实验先探索不同胰岛素对脂肪细胞分化的影响。我们观察到3T3-L1前脂肪细胞在10-6 mol·L-1胰岛素之下分化处理3~6 d后,油脂逐渐堆积于细胞内,与Cowherd等[6]实验观察相近。细胞90%以上转化为脂肪细胞,具有最好的分化效果所以在以后的实验中,以3T3-L1脂肪细胞为实验材料时,胰岛素以10-6 mol·L-1浓度作为分化条件。
随后,我们考察了3T3-L1脂肪细胞诱导成胰岛素抵抗细胞的最佳诱导时间及稳定性。我们发现3T3-L1脂肪细胞在1 μmol·L-1 DEX条件下培养96 h后,葡萄糖消耗率也达到最大30.18%。稳定性试验发现,3T3-L1脂肪细胞在36 h内,上清液中的葡萄糖消耗值与对照组比较均具有显著性差异(P < 0.001),因此,IR-3T3-L1脂肪胰岛素抵抗细胞最佳的诱导培养条件为:1 μmol·L-1 DEX、0.5 mmol·L-1 IBMX和10-6 mol·L-1 Insulin诱导分化为成熟的脂肪细胞后,再用1 μmol·L-1 DEX培养96 h即可成功诱导为脂肪胰岛素抵抗细胞,在36 h内稳定。
| [1] | Palacios-Ortega S, Varela-Guruceaga M, Milagro FI, et al. Expression of Caveolin1is enhanced by DNA demethylation during adipocyte differentiation.status of insulin signaling[J]. PLoS One,2014, 9 (4) : e95100. DOI: 10.1371/journal.pone.0095100. |
| [2] | Donati G, Proserpio V, Lichtenberger BM, et al. Epidermal Wnt/β-catenin signaling regulates adipocyte differentiation via secretion of adipogenic factors[J]. Proc Natl Acad Sci USA,2014, 111 (15) : E1501-9. DOI: 10.1073/pnas.1312880111. |
| [3] | Huang CC, Huang WC, Hou CW, et al. Effect of black soybean koji extract on glucose utilization and adipocyte differentiation in3T3-L1cells[J]. Int J Mol Sci,2014, 15 (5) : 8280-92. DOI: 10.3390/ijms15058280. |
| [4] | Ramirez-Zacarias JL, Castro-Munozledo F, Kuri-Harcuch W. Quantitation of adipose conversion and triglycerides by staining intracytoplasmic lipids with Oil red O[J]. Histochemistry,1992, 97 (6) : 493-7. DOI: 10.1007/BF00316069. |
| [5] | Fujimoto Y, Nakagawa Y, Shingyouchi A, et al. Dicer has a crucial role in the early stage of adipocyte differentiation, but not in lipid synthesis, in3T3-L1cells[J]. Biochemical and Biophysical Research Communications,2012, 420 (4) : 931-6. DOI: 10.1016/j.bbrc.2012.03.110. |
| [6] | Cowherd RM, Lyle RE, McGehee Jr RE. Molecular regulation of adipocyte differentiation[J]. Semin Cell Dev Biol,1999, 10 (1) : 3-10. DOI: 10.1006/scdb.1998.0276. |
| [7] | Green H, Kehinde O. Formation of normally differentiated subcutaneous fat pads by an established preadipose cell line[J]. J Cell Physiol,1979, 101 (1) : 169-71. DOI: 10.1002/(ISSN)1097-4652. |
| [8] | Zhang Q, Zhang Y, Feng H, et al. High density lipoprotein (HDL) promotes glucose uptake in adipocytes and glycogen synthesis in muscle cells[J]. PLoS One,2011, 6 (8) : e23556. DOI: 10.1371/journal.pone.0023556. |
| [9] | Singh J, Kakkar P. Modulation of liver function, antioxidant responses, insulin resistance and glucose transport by Oroxylum indicum stem bark in STZ induced diabetic rats[J]. Food Chem Toxicol,2013, 62 : 722-31. DOI: 10.1016/j.fct.2013.09.035. |
| [10] | Richard AJ, Amini-Vaughan Z, Ribnicky DM, et al. Naringenin inhibits adipogenesis and reduces insulin sensitivity and adiponectin expression in adipocytes[J]. Evid Based Complement Alternat Med,2013, 2013 : 549750. |
| [11] | Kong P, Chi R, Zhang L, et al. Effects of paeoniflorin on tumor necrosis factor-α-induced insulin resistance and changes of adipokines in3T3-L1adipocytes[J]. Fitoterapia,2013, 91 : 44-50. DOI: 10.1016/j.fitote.2013.08.010. |
| [12] | Yi P, Lu FE, Xu LJ, et al. Berberine reverses free-fatty-acid-induced insulin resistance in3T3-L1adipocytes through targeting IKKbeta[J]. World J Gastroenterol,2008, 14 (6) : 876-83. DOI: 10.3748/wjg.14.876. |
| [13] | 张颖, 陈可冀, 杨领海, 等. 西洋参茎叶总皂苷对脂肪细胞糖脂代谢及胰岛素抵抗信号转导的影响[J]. 中国中西医结合杂志,2010, 7 : 748-51. |
| [14] | 叶夏云, 薛耀明, 沙建平, 等. 血清淀粉样蛋白A在3T3-L1脂肪细胞的表达及其与胰岛素抵抗的关系[J]. 南方医科大学学报,2009, 29 (5) : 1020-3. |
| [15] | Garcia de Herreros A, Birnbaum MJ. The acquisition of increased insulin-responsive hexose transport in3T3-L1adipocytes correlates with expression of a novel transporter gene[J]. J Biol Chem,1989, 264 (33) : 19994-9. |
| [16] | Weiland F, Verspohl EJ. Variety of angiotensin receptors in3T3-L1preadipose cells and differentiated adipocytes[J]. Horm Metab Res,2008, 40 (11) : 760-6. DOI: 10.1055/s-0028-1082041. |
| [17] | Eseberri I, Lasa A, Churruca I, Portillo MP. Resveratrol metabolites modify adipokine expression and secretion in3T3-L1preadipocytes and mature adipocytes[J]. PLoS One,2013, 8 (5) : e63918. DOI: 10.1371/journal.pone.0063918. |
| [18] | 朱慧丽, 翁泽平, 林琛莅, 等. GLP-1通过下调ATGL表达参与3T3-L1脂肪细胞脂质代谢[J]. 南方医科大学学报,2013, 33 (10) : 1499-503. |
 2015, Vol. 35
2015, Vol. 35
