2. 西安交通大学 第一附属医院血液内科,陕西 西安 710061 ;
3. Metabolic Program, Mater Research Institute-University of Queensland, Translational Research Institute, Brisbane, Queensland, Australia
2. Department of Hematology, First Affiliated Hospital, Xi'an Jiaotong University School of Medicine, Xi'an 710061, China ;
3. Metabolic Program, Mater Research Institute-University of Queensland, Translational Research Institute, Brisbane, Queensland, Australia
哺乳动物体内存在两类形态与功能不同的脂肪组织:白色脂肪组织(WAT)和棕色脂肪组织(BAT),白色脂肪组织根据部位不同又分为皮下白色脂肪组织(sWAT)和内脏白色脂肪组织(vWAT)[1]。每种脂肪组织表现出各自独特的生理功能。WAT是能量贮存的场所,而BAT的主要功能是燃烧脂质,将能量转化为热量,是能量消耗的部位[2]。新近研究表明,BAT和sWAT有助于调节机体内血糖的平衡,提高机体能量的消耗,维持机体代谢稳态;而vWAT则与糖尿病等多种代谢性疾病的发生有密切相关[3]。骨形态发生蛋白及激活素胞膜绑定抑制因子(BMP and activin membrane-bound inhibitor, BAMBI)最初是由Gawantka等[4]于1998年在筛选非洲蟾蜍卵母细胞中与BMP-4信号通路相关基因时发现的,由于其胞外结构域与转化生长因子(TGF-β)和骨形成蛋白(BMP)等配体的Ⅰ型受体胞外结构域相似但缺失胞内信号转导结构域,因而也称为伪受体[5]。近年研究发现BAMBI基因参与调控胚胎发育及多种组织器官的肿瘤形成,并参与调控多种与脂肪细胞形成有关的自分泌/旁分泌细胞因子,其中包括TGF超家族成员(TGF-β和BMP)和Wnts[6-8]。然而BAMBI在脂肪细胞形成中的作用还鲜见报道。本课题组新近研究发现,在人脂肪细胞形成过程中,BAMBI基因起着显著的负调控作用[9]。但BAMBI在小鼠脂肪发育过程中的表达及调控作用还未为可知,因此,本研究利用实时定量PCR及Western blot技术分析检测小鼠不同类型脂肪组织发育过程中BAMBI mRNA及蛋白的表达规律,并测定BAMBI在小鼠原代前体脂肪细胞分化过程中的转录表达时序变化,为进一步研究BAMBI在脂肪形成过程中的作用机理提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验动物胚胎18 d、生后0 d、21 d、8周和6月龄健康C57BL/6J小鼠各5只,雌雄不限,由西安交通大学实验动物中心提供。断颈处死,取肩胛部位BAT,腹股沟部位sWAT和性腺周围vWAT,立即在液氮中冷冻,-80 ℃储存备用。生后21 d小鼠断颈处死后无菌条件下取腹股沟部位sWAT,用于细胞培养。
1.1.2 试剂DMEM/F12培养基(GIBCO),Ⅰ型胶原酶(Sigma),胎牛血清(GIBCO),牛血清白蛋白,胰岛素,地塞米松,罗格列酮,吲哚美辛,3-异丁基-1-甲基黄嘌呤, 甲状腺素(Sigma),Trizol (Invitrogen),反转录试剂盒RevertAid First Strand cDNA Synthesis Kit (Thermo),实时定量SYBR Premix Ex Taq Ⅱ(TaKaRa),山羊抗鼠BAMBI多克隆抗体(R & D system)。
1.2 方法 1.2.1 前体脂肪细胞的分离培养无菌采集小鼠腹股沟部位sWAT,剪成2~3 mm3左右的小块。将脂肪组织小块放入4倍于小块体积的胶原酶消化液中,置于37 ℃孵箱中震荡消化60 min。消化物通过孔径为280 μm的尼龙筛,收取过滤液,离心10 min(700 g;4 ℃)。弃上清及漂浮的成熟脂肪细胞,获基质微管层(Stromal vascularf raction, SVF),加入5 ml红细胞裂解液并于室温静置10 min,离心10 min(700 g;4 ℃)。然后,用完全培养液将消化分离出的细胞稀释,吹打均匀,以5×104个/ml密度接种于25 cm2培养瓶中。置于培养箱(37 ℃,饱和湿度,5% CO2)培养,24 h后换培养液,以除去未贴壁细胞,之后每3 d换1次液。
1.2.2 总RNA的提取及cDNA第一链的合成按照Trizol总RNA提取试剂盒说明书提取组织及诱导分化的第0、3、7、11天脂肪细胞RNA,提取完成后,Nanodrop检测RNA的纯度及浓度,并利用Thermo反转录试剂盒合成cDNA。
1.2.3 实时定量PCR(real time PCR)20 μl PCR反应体系(Bio-Rad iQ5):ddH2O 4 μl、cDNA模板2 μl、2 μmol/L上游引物2 μl、2 μmol/L下游引物2 μl、SYBR green 10 μl。反应条件:95 ℃预变性5 s,每个循环60 ℃ 20 s。实验数据利用Rotor Gene real time Analysis Software 6.0分析,标准Ct值设置为0.035,以cyclophilin为内参基因,目的基因的值=2^(Ct Ref Gene-Ct GOI)。实时定量PCR所用引物序列如下:BAMBI F-5' GCAAT TATCGAGGACTGCATGAC3'R-5'GCGGAACCACA GTTCTTTGGAG3';cyclophilin F-5'CATACAGGTC CTGGCATCTTGTC3',R-5' CATACAGGTCCTGGCA TCTTGTC3'。
1.2.4 Western blot分析利用匀浆器提取组织总蛋白,采用BSA方法测定蛋白浓度。蛋白样本经聚丙烯酰胺凝胶电泳分离后,转移到PVDF膜上(30 V 4 ℃过夜)。将目的条带处的膜剪下,利用含5%脱脂奶粉的TBS-T室温封闭1 h,一抗4 ℃孵育过夜,二抗室温孵育1 h。利用BioRad成像软件系统分析蛋白条带。
1.2.5 数据统计分析采用GraphPad Prism 5.0软件进行:如无特殊说明,均采用t检验分析两组数据之间的差异显著性,采用单因素方差分析结合Tukey's post-hoc检验分析3组以上数据之间的差异显著性,数据表示为均数±标准差,P < 0.05视为差异显著。
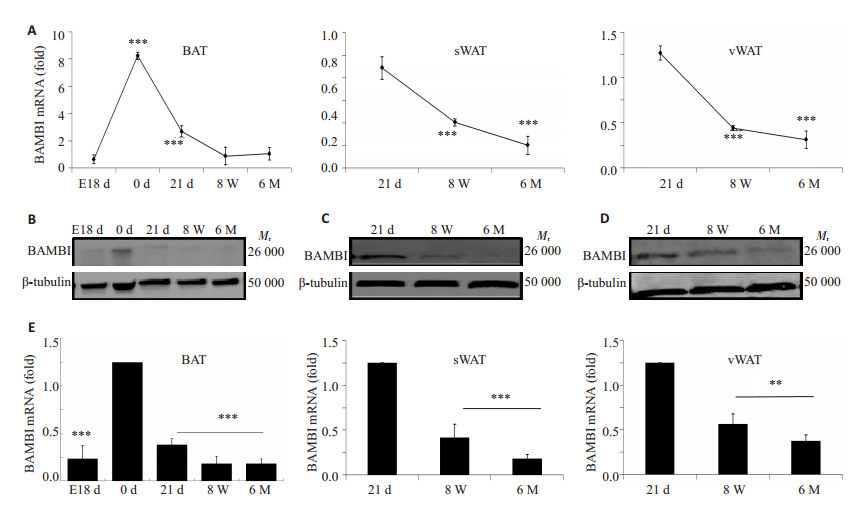
2 结果与分析 2.1 脂肪组织发育过程中BAMBI的差异表达为了探明BAMBI基因在小鼠脂肪组织发育过程中的表达规律,我们选取脂肪组织发育过程中具有代表性的时段:胚胎期第18天,出生0 d,离乳期即出生后21 d,性成熟期即出生后8周及6月龄,分别采集BAT,sWAT,vWAT,提取总RNA和总蛋白,利用实时定量PCR检测BAMBI基因的表达,Western blot分析BAMBI蛋白的表达情况。结果显示,在胚胎期第18天的BAT中,BAMBI基因表达量处于较低的水平;而在出生后第0天的BAT中,其表达量显著上升;随着生长发育,BAMBI mRNA表达量逐渐降低,21 d时较刚出生时的表达量显著降低,之后一直维持在一个较低的水平(图 1A)。在sWAT和vWAT中,BAMBI mRNA的表达趋势大致相同,均随着生长发育而表达量显著降低(图 1A)。进一步对BAMBI蛋白的检测得知,在BAT中,BAMBI只在出生的第0天高表达,而其他时间段均显著低表达(图 1B、E);而sWAT和vWAT中BAMBI蛋白表达也是随着生长发育进程而逐渐降低(图 1C~E)。上述结果提示,BAMBI基因在小鼠脂肪组织发育初期表达量较高,随着脂肪发育成熟而逐渐降低,之后维持在一个较低的水平。
|
图 1 BAMBI在脂肪组织发育过程中的表 Figure 1 Changes in the expression of BAMBI in different adipose tissues of mice at different developmental stages. A: Changes of BAMBI mRNA expression detected by real-time PCR in BAT, sWAT and vWAT (n=5, Mean±SE from triplicate determinations). ***P < 0.001 vs E18 d (BAT) or 21 d (sWAT and vWAT). B, C, D: Western blotting of BAMBI in whole BAT (B), sWAT (C) and vWAT (D) lysate with β-tubulin as the loading control; E: Quantification of Western blot analysis from 3-6 independent experiments (Mean±SE). Results are expressed as fold changes relative to 0 d (BAT) or 21 d (sWAT and vWAT). **P < 0.01, ***P < 0.001. E18 d: Embryonic day 18; 0 d or 21 d: Postnatal day 0 or 21; 8 W: 8 week old; 6 M: 6 month old. |
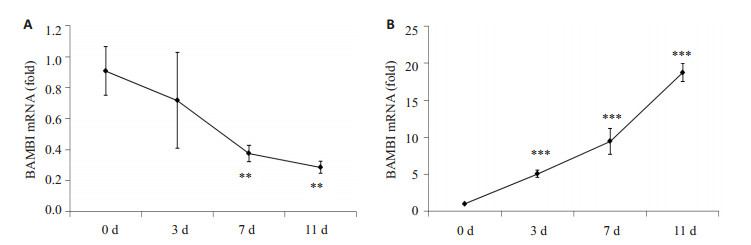
为了印证脂肪组织中BAMBI基因的表达规律,我们分离培养小鼠腹股沟部位sWAT的前体脂肪细胞,并诱导分化至成熟,在脂肪细胞分化的第0天,第3天,第7天及第11天分别提取脂肪细胞总RNA,实时定量PCR检测BAMBI与分化标志基因过氧化物酶体增殖物激活受体γ(PPARγ)mRNA的表达变化。结果如图 2A所示,分化第7天及第11天与分化第0天相比,BAMBI mRNA的表达量显著降低,而第7天相比第11天的表达量无显著差异,提示BAMBI在分化第7天开始维持在较低的表达水平。而作为脂肪细胞分化的标志基因,PPARγ mRNA表达量呈现时间依赖式升高(图 2B)。
|
图 2 小鼠原代前体脂肪细胞分化过程中BAMBI和PPARγ mRNA的表达 Figure 2 Gene expression in primary mouse preadipocytes at different differentiation time. BAMBI (A) and PPARγ (B) mRNA expression were determined by real time PCR in preadiocytes obtained from inguinal adipose tissue at differentiation day 0, 3, 7 and 11. Results are Means±SE from triplicate determinations. **P < 0.01 and ***P < 0.001 vs differentiation day 0. |
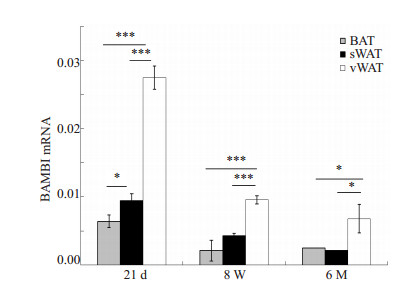
为了进一步研究BAMBI在不同类型脂肪组织中的表达差异,我们检测了同一时段BAT,sWAT和vWAT中的BAMBI mRNA表达水平,实时定量PCR结果如图 3所示,在脂肪组织发育的3个时间段,vWAT中BAMBI的表达量均显著高于其在BAT和sWAT中的表达量;而在21 d sWAT中的表达量又显著高于同时段BAT中含量。上述结果显示,尽管在不同类型脂肪组织发育过程中BAMBI mRNA的表达趋势相同,但表达量却存在显著差异。
|
图 3 BAMBI在小鼠不同脂肪组织中的差异表达 Figure 3 BAMBI and PPARγ expression detected by real-time PCR during differentiation of primary mouse preadipocytes from inguinal adipose tissue. Results are Mean±SE from triplicate determinations. **P < 0.01, ***P < 0.001 vs differentiation day 0. |
BAMBI基因自发现以来,由于在介导细胞间信号转导过程中起着十分重要的调控作用,其重要的生理功能就一直成为研究者所关注的热点。然而目前对于BAMBI的研究主要集中在对胚胎发育和肿瘤形成的影响等方面[10-13]。本课题组前期通过基因芯片分析发现,BAMBI基因的表达量在FGF-1促人脂肪细胞分化过程中下调幅度最大,并证实BAMBI在人脂肪细胞分化过程中起负调控作用[9],然而其在正常机体内脂肪组织发育过程中的表达情况如何,至今仍未见报道。C57BL/ 6J小鼠是广泛用于生命科学研究的实验动物,它的脂肪组织生长发育具有一定的规律,在生长发育的早期(第14天到离乳期21 d),一般是以脂肪细胞的定向分化为主,而在生长发育的后期(性成熟期8周及以后)则以成熟脂肪细胞分化特性的维持、脂滴充盈为主[14]。不同类型的脂肪组织其生长发育的时间有一定差异,vWAT在出生后开始形成,sWAT虽在第14天开始出现,但其分化持续时间较长[14]。vWAT和sWAT均在出生后21 d左右才形成肉眼可见的脂肪组织垫。而BAT虽在胚胎期形成,但小鼠刚出生时其功能最为活跃[15]。本研究选取小鼠脂肪组织生长发育的不同时段研究BAMBI的表达规律,结果显示,从出生到21 d,BAMBI mRNA和蛋白的表达量处于较高的水平,但8周以后其表达量就显著降低,且之后一直维持在较低的水平,这说明,BAMBI在脂肪组织发育前期高表达,可能更多地影响脂肪细胞的定向分化而非脂肪细胞分化特性的维持。但值得一提的是,在胚胎期BAT中,BAMBI mRNA和蛋白却处于低表达水平,刚出生时其表达量达到最大,这是否受BAT特殊的发育过程影响还有待进一步研究。
为了进一步探讨在脂肪细胞定向分化过程中BAMBI mRNA的表达规律,我们分离培养了小鼠sWAT原代前体脂肪细胞并诱导分化成熟,在分化过程中的不同时间点检测了BAMBI及PPARγ mRNA表达,结果显示,脂肪细胞分化过程中随着PPARγ表达量的升高,BMABI表达量逐渐降低,在检测的第7天出现显著差异,之后一直维持在较低的表达水平,其表达模式与我们之前报道FGF-1促进PPARγ高表达的过程中下调BAMBI基因的表达相一致[9]。这提示,BAMBI在小鼠脂肪组织发育过程中尤其是定向分化阶段起着负调控的作用。
哺乳动物体内的脂肪组织因部位及功能不同分为两种类型。BAT以产热及对抗肥胖为主,是机体内清除甘油三酯最大的器官[16]。研究表明,小鼠机体内缺少BAT更容易产生饮食诱导的肥胖和胰岛素抵抗[17-20]。而vWAT的堆积较sWAT而言,更易造成胰岛素抵抗、糖利用障碍、脂肪分解增加,是代谢综合征发生的关键因素[21-22]。本研究通过检测不同类型不同发育阶段的脂肪组织BAMBI mRNA表达量,发现其在vWAT中的表达量在不同发育阶段均显著高于在sWAT和BAT中的表达量。我们前期研究得知,BAMBI在饮食诱导的肥胖小鼠和ob肥胖小鼠脂肪组织中表达量显著下调[9]。而Wanninger等[11]也证实,BAMBI的表达与BMI呈负相关。结合本研究所得数据分析,推测BAMBI表达量与机体代谢稳态可能存在相关性,其具体机制尚不明确。
自本课题组研究发现BAMBI基因在人脂肪细胞形成中的作用后,其在脂肪组织发育及机体能量代谢中的作用机制逐渐引起人们的关注。本研究初步探讨了BAMBI在小鼠不同类型脂肪组织发育的各个阶段和原代前体脂肪细胞分化过程中的表达规律。但BAMBI基因如何参与调节脂肪形成,维持机体代谢稳态?其表达量的改变是否与肥胖及相关代谢疾病的发病机制密切相关?这都需要进一步研究证实。我们目前已经成功繁育了BAMBI基因敲除小鼠,BAMBI基因在脂肪组织功能和生理代谢功能方面的作用及机制正在进一步研究中。
| [1] | Gesta S, Tseng YH, Kahn CR. Developmental origin of fat: Tracking obesity to its source[J]. Cell,2007, 131 (2) : 242-56. DOI: 10.1016/j.cell.2007.10.004. |
| [2] | Farmer SR. Molecular determinants of brown adipocyte formation and function[J]. Genes Dev,2008, 22 (10) : 1269-75. DOI: 10.1101/gad.1681308. |
| [3] | Tran TT, Kahn CR. Transplantation of adipose tissue and stem cells: role in metabolism and disease[J]. Nat Rev Endocrinol,2010, 6 (4) : 195-213. DOI: 10.1038/nrendo.2010.20. |
| [4] | Gawantka V, Pellet N, Delius H, et al. Gene expression screening in Xenopus identifies molecular pathways, predicts gene function and provides a global view of embryonic patterning[J]. Mech Dev,1998, 77 (2) : 95-141. DOI: 10.1016/S0925-4773(98)00115-4. |
| [5] | Onichtchouk D, Chen YG, Dosch R, et al. Silencing of TGF-beta signalling by the pseudoreceptor Bambi[J]. Nature,1999, 401 (6752) : 480-5. DOI: 10.1038/46794. |
| [6] | Fritzmann J, Morkel M, Besser D, et al. A colorectal Cancer expression profile that includes transforming growth factor beta inhibitor Bambi predicts metastatic potential[J]. Gastroenterology,2009, 137 (1) : 165-75. DOI: 10.1053/j.gastro.2009.03.041. |
| [7] | Sekiya T, Adachi S, Kohu K, et al. Identification of BMP and activin membrane-bound inhibitor (Bambi), an inhibitor of transforming growth factor-beta signaling, as a target of the betacatenin pathway in colorectal tumor cells[J]. J Biol Chem,2004, 279 (8) : 6840-6. |
| [8] | Sasaki T, Sasahira T, Shimura H, et al. Effect of Nma on growth inhibition by TGF-betaa in human gastric carcinoma cell lines[J]. Oncol Rep,2004, 11 (6) : 1219-23. |
| [9] | Luo X, Hutley LJ, Webster JA, et al. Identification of BMP and activin Membrane-Bound inhibitor (Bambi) as a potent negative regulator of adipogenesis and modulator of autocrine/paracrine adipogenic factors[J]. Diabetes,2012, 61 (1) : 124-36. DOI: 10.2337/db11-0998. |
| [10] | Pils D, Wittinger M, Petz M, et al. Bambi is overexpressed in ovarian Cancer and co-translocates with Smads into the nucleus upon TGF-beta treatment[J]. Gynecol Oncol,2010, 117 (2) : 189-97. DOI: 10.1016/j.ygyno.2009.12.034. |
| [11] | Wanninger J, Neumeier M, Bauer S, et al. Adiponectin induces the transforming growth factor decoy receptor Bambi in human hepatocytes[J]. FEBS Lett,2011, 589 (9) : 1338-44. |
| [12] | Knight C, Simmons D, Gu TT, et al. Cloning, characterization, and tissue expression pattern of mouse Nma/Bambi during odontogenesis[J]. J Dent Res,2001, 80 (10) : 1895-902. DOI: 10.1177/00220345010800100701. |
| [13] | Gonzales CB, Simmons D, Macdougall M. Competing roles of TGF beta and Nma/Bambi in odontoblasts[J]. J Dent Res,2010, 89 (6) : 597-602. DOI: 10.1177/0022034510363363. |
| [14] | Wang QA, Tao C, Gupta RK, et al. Tracking adipogenesis during white adipose tissue development, expansion and regeneration[J]. Nat Med,2013, 19 (10) : 1338. DOI: 10.1038/nm.3324. |
| [15] | Symonds ME. Brown adipose tissue growth and development[J]. Scientifica (Cairo),2013 : 305763. |
| [16] | Bartelt A, Bruns OT, Reimer R, et al. Brown adipose tissue activity controls triglyceride clearance[J]. Nat Med,2011, 17 (2) : 200-5. DOI: 10.1038/nm.2297. |
| [17] | Connolly E, Morrisey RD, Carnie JA. The effect of interscapular brown adipose tissue removal on body-weight and cold response in the mouse[J]. Br J Nutr,1982, 47 (3) : 653-8. DOI: 10.1079/BJN19820077. |
| [18] | Lowell BB, Ss VS, Hamann A, et al. Development of obesity in transgenic mice after genetic ablation of brown adipose tissue[J]. Nature,1993, 366 (6457) : 740-2. DOI: 10.1038/366740a0. |
| [19] | Hamann A, Flier JS, Lowell BB. Decreased brown fat markedly enhances susceptibility to diet-induced obesity, diabetes, and hyperlipidemia[J]. Endocrinology,1996, 137 (1) : 21-9. |
| [20] | Feldmann HM, Golozoubova V, Cannon BA. UCP1 ablation induces obesity and abolishes diet-induced thermogenesis in mice exempt from thermal stress by living at thermoneutrality[J]. Cell Metab,2009, 9 (2) : 203-9. DOI: 10.1016/j.cmet.2008.12.014. |
| [21] | Ross R, Aru J, Freeman J, et al. Abdominal adiposity and insulin resistance in obese men[J]. Am J Physiol Endocrinol Metab,2002, 282 (3) : E657-63. DOI: 10.1152/ajpendo.00469.2001. |
| [22] | Gabriely I, Ma XH, Yang XM, et al. Removal of visceral fat prevents insulin resistance and glucose intolerance of aging:an adipokine-mediated process[J]. Diabetes,2002, 51 (10) : 2951-8. DOI: 10.2337/diabetes.51.10.2951. |
 2015, Vol. 35
2015, Vol. 35
