2汉中市中心医院,陕西 汉中 723000
2Hanzhong Central Hospital, Hanzhong, 723000, China
骨性关节炎(OA),又称增生性关节炎、肥大性关节炎,是关节活动受限的一种退行性疾病[1],病理变化主要为关节软骨的退变、骨刺的形成及关节组织的炎性改变,致病因素多为老龄化和过度应力,好发于训练过度的运动员和老年人。随着社会老龄化的到来,估计全球骨关节炎患病者高达3.5亿以上,在我国65岁以上患病者,有一半以上为罹患OA患者,约有5000万[2, 3],严重影响患者的生活质量,也给社会带来沉重的经济负担,因此寻求有效治疗手段缓解膝骨关节炎疼痛成为医学界亟待解决的难题。大量研究表明,电针能缓解膝骨关节炎(KOA)引起的关节僵硬、疼痛及功能障碍[4, 5, 6],短刺法是古代治疗KOA的首要针法,临床验证短刺法治疗KOA有良好疗效且效果优于常规针刺法[7, 8]。研究发现:抑制软骨细胞肥大进程已作为治疗骨关节炎的新靶点[9]。Y染色体的性别决定区域(Sox9)在软骨细胞和组织分化成熟中发挥关键作用[10],能结合软骨细胞肥大的标志产物Ⅹ型胶原(ColⅩ)基因的启动子激活其表达[11],肥大的软骨细胞化能诱导基质矿化,分泌血管内皮生长因子(VEGF)因子导致血管入侵,形成骨赘。本实验观察短刺法对膝骨关节炎家兔模型软骨细胞中Sox9,VEGF和ColⅩ表达的影响,探讨KOA的发病机制及短刺法治疗KOA的机制。
1 材料和方法 1.1 主要试剂及检测设备Sox9(bs-4177R)、VEGF(bs-1313R)和Col Ⅹ (bs-0554R)一抗购自北京博奥森生物技术有限公司, HRP(sp-9001-3 mL)标记二抗购自北京康为生物试剂公司,一次性针灸针(规格:0.30 mm×25 mm、0.30 mm× 40 mm、0.30 mm×50 mm华佗牌),电针治疗仪(南京LH200),手术器械(上海手术器械厂),PCR 仪器(Applied Biosy Stems),光学显微镜(MODEL BX51TF, TOKYO,JAPAN)低温离心机(SIGAM公司),石蜡切片机(Leica SM2000R,德国)、电子显微镜(iMark-14047, 上海)、凝胶成像系统(BIO-RAD)、离心机(长沙湘仪离心机仪器有限公司)等(由重庆医科大学生物工程实验室提供),数字放射成像系统(DR3000,由重庆医科大学附属第一医院放射科提供)。
1.2 动物分组及模型复制健康新西兰兔40只,购自重庆医科大学动物中心, 许可证号:SYXK(渝)2012-0001。雌雄各半,雌无孕, 体质量2.0~2.5 kg,实验中对待动物遵循动物伦理学标准。利用随机对照表随机分为正常组(N组)10只、造模组30只。造模组行Hulth手术法[12]复制膝骨关节炎模型:将造模组新西兰兔经耳缘静脉注射3%戊巴比妥钠(30 mg/kg),深度麻醉后常规备皮、消毒、铺手术巾,于左侧膝关节间隙处取纵行切口,挑开皮肤,暴露内侧副韧带,切断内侧副韧带及周围韧带组织,打开关节囊,剔除内侧半月板,切断前后交叉韧带,行抽屉实验阳性后, 清理关节腔,逐层缝合皮肤。术后肌肉注射青霉素钠(4 万U/kg)防止感染,1次/d,连续7 d,术后6周,对所有新西兰兔膝关节进行X线检测,满足软骨下骨显露、硬化、 关节间隙变窄、膝关节对线不良等[13],可判断造模成功, 将造模成功的新西兰兔随机分为3组:对照组(M组)、 短刺组(CN组)、普通针刺组(NTN组),每组10只。
1.3 治疗方法将CN组新西兰兔仰卧位固定,捆绑四肢,参照《实验针灸学》选取左膝关节单侧“内外膝眼”“梁丘”“足三里”和“阴陵泉”穴,内外膝眼选用1.5寸毫针,向关节腔内斜刺,抵骨贴骨进针,进针约1寸(30 mm)(针刺内外膝眼正常范围为1.5寸);梁丘选用2寸毫针,斜刺至股骨,针尖透过股骨骨膜,透刺血海穴,进针约1.5 寸(50 mm),;足三里穴选用1.5寸毫针,采用董氏奇穴针刺法,贴胫骨边缘进针1寸(30 mm);阴陵泉选用1.5寸毫针,靠近胫骨内侧贴骨深刺,进针约1 寸(30 mm)。 NTN组固定方式和选穴与CN组一致,采用1寸毫针,直刺或斜刺0.5寸(15 mm)左右,不贴骨抵骨进针,两组均使用平补平泻手法,得气后连接电针仪,一组电极连接内外膝眼,一组电极连接足三里和阴陵泉,疏密波刺激20 min,频率1.6~2 Hz,以局部肌肉轻微刺激为度(电压4~6 V,电流1~3 mA),1次/d,5 d一疗程,每一疗程间隔2 d,连续4周。N组和M组固定方式、疗程与CN组一致但不做任何治疗。
1.4 X线检测采用Hulth法复制膝骨关节炎模型6周后,对正常组和造模组新西兰兔左膝骨关节进行X线检测,观察两组兔膝骨关节之间的变化。所有新西兰兔X线检测均在重庆医科大学附属第一医院进行,X线参数:(照射量:32 mAs;照射电流:250 mA;照射电压:60 Kvp;照射时间128 ms)。
1.5 行为学检测分别在治疗前和治疗结束后观察兔膝关节局部反应、关节活动、关节肿胀和步态改变,用Lequesne MG 膝关节评估级别方法[14]进行评分,Lequesne MG评分标准:局部疼痛刺激反应:用棉签触碰手术侧膝关节,无异常疼痛反应为Ⅰ级,患肢收缩为Ⅱ级,患肢痉挛收缩,伴肢体轻度反应为Ⅲ级,患肢收缩强烈,全身震颤挣扎为Ⅳ级;步态:患肢跑动正常,蹬地有力为Ⅰ级,患肢跑动时轻度跛行,蹬地有力为Ⅱ级,患肢能行走但跛行明显为Ⅲ级,患肢不能行走,不能蹬地及触地为Ⅳ级;关节活动(伸直为0°):患肢伸直90°以上为Ⅰ级,伸直45°~90° 为Ⅱ级,伸直15°~45°为Ⅲ级,15°以下为Ⅳ级;关节肿胀:关节无肿胀,骨性标记清楚为Ⅰ级,轻度肿胀,骨性标记变浅为Ⅱ级,肿胀明显,骨性标记消失为Ⅲ级,等级分值依次为0分,1分,2分,3分,总分为11分。
1.6 膝关节软骨观察和形态学检测治疗4 周后,将4 组新西兰兔经3%戊巴比妥钠(30 mg/kg)麻醉后,立即剥离皮肤,断离膝关节,用手术刀迅速剥离附着肌肉组织,取下关节面软骨及内侧半月板,分为两部分,一部分放入迅速放入液氮保存,移至负80 ℃冷冻,一部分放入4%多聚甲醛固定,将放入多聚甲醛的软骨进行常规脱钙,磷酸盐冲液冲洗,石蜡包埋,4~ 5 μm连续切片,进行HE染色和甲苯胺蓝染色,应用Mankin评分法[15]对甲苯胺蓝染色切片进行评定,判断骨关节炎严重程度。
1.7 Westem-blot检测取液氮的软骨标本约40 mg,用细胞裂解法提取软骨总蛋白,粉碎后离心10 min,BCA蛋白定量法测定蛋白浓度,收集上清液,提取等量蛋白,SDS-PAGE凝胶电泳后转至PVDF 膜封闭,加入Sox9 和ColⅩ一抗(1∶ 500),4 ℃摇床过夜,37 ℃复温后加二抗(1∶1000),孵育后漂洗显色,用GAPDH 做内参重复上述步骤, Quantity One 4.6软件分析条带灰色值(目的蛋白相对含量计算公式:目的蛋白灰度值/GAPDH灰度值)。
1.8 免疫组织化学检测取出放入4%多聚甲醛保存的软骨标本固定24 h 后,石蜡切片4~5 μm连续切片,二甲苯脱蜡,采用复合消化液进行酶修复,室温下孵育30 min,PBS冲洗,先后加入3%双氧水过氧化物酶活性、山羊血清孵育后,分别滴加VEGF和ColⅩ一抗(稀释度1∶100),4 ℃过夜,室温下孵育30 min,加生物素标记山羊抗兔、辣根酶标记链酶工作液后,滴加DAB显色试剂,显微镜下观察5 min,棕色或黄色显示为阳性,苏木精复染15 min,脱水后放入碳酸锂3 s,切片用酒精脱水干燥,中性树胶封片,做阴性对照用PBS代替一抗。
1.9 逆转录聚合链式反应(RT-PCR)检测取出液氮下保存的软骨组织,按照试剂盒和逆转录试剂盒说明书进行RNA提取和c-DNA的制备,Sox9引物:上游:5'GGCGGAGGAAGTCGGTGAAG 3',下游: 5'GCCGGGGGAATGGACCTC 3',VEGF引物:上游: 5'TGGCCGTCTGCTGGGAGTG 3',下游:5'CCGGGC TACTACTTCGTCCACTC 3',以b-actin 作为内参对照,上游:5'ACCCCGTGCTGCTGACCGAG 3',下游: 5'TCCCGGCCAGCCAGGTCCA 3',以上引物均由重庆海韵生物技术有限公司合成,经吸光度扫描仪扫描后,用PCR条带软件进行定量分析,结果为基因表达量对内参的比值。
2.0 统计学处理应用SPSS 17.0软件进行数据统计分析,所有实验数据采用均数±标准差表示,组内比较使用单因素方差分析法,组间差异比较采用LSD检验,以P<0.01为差异有统计学意义。
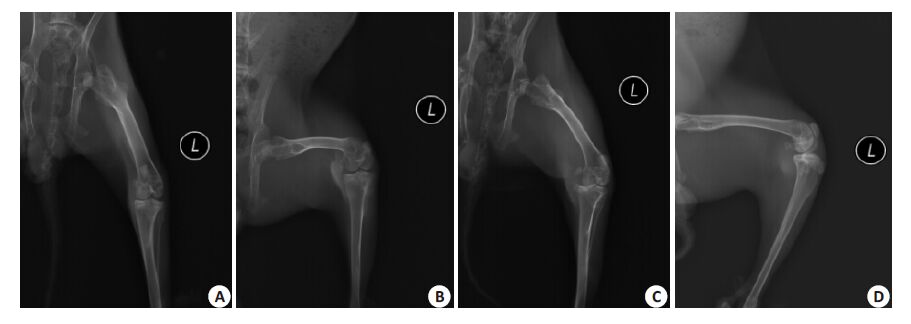
2 结果 2.1 X线检测结果从图1可见:正常组新西兰兔膝关节边缘整齐,间隙正常,关节面平整,关节对线良好,无骨赘形成。造模6周后造模组新西兰兔膝关节边缘有明显骨赘形成,关节间隙变窄,关节面变形,关节对线不良。
|
图1 X线观察新西兰兔膝骨关节变化 Fig.1 Changes of the rabbits' knee joints observed by X-ray. A: Frontal view of the joint of a normal rabbit; B: Lateral view of the joint of a normal rabbit; C: Frontal view of the joint of a rabbit with KOA; D: Lateral view of the joint of a rabbit with KOA. |
N组Lequesne MG评分在0~1分,行为学正常,与N 相比,治疗前M、CN、和NTN组Lequesne MG评分显著增高,有统计学差异(P<0.01)。M、CN、NTN组在治疗前Lequesne MG评分比较差异无统计学差异(P>0.01),兔膝关节局部刺激疼痛反应强烈,关节肿胀明显,关节活动度多在45°~90°;治疗后CN和NTN组兔关节局部刺激疼痛反应有所减轻,肿胀稍减轻,关节活动度多在15° ~45°,与M组相比,CN和NTN组评分显著降低,其中CN组降低更加明显,有统计学差异(P<0.01,表1)。
| 表1 兔行为学Lequesne MG结果 Table 1 Scores of equesne MG algofunctional index of the rabbits (n=10, Mean±SD) |
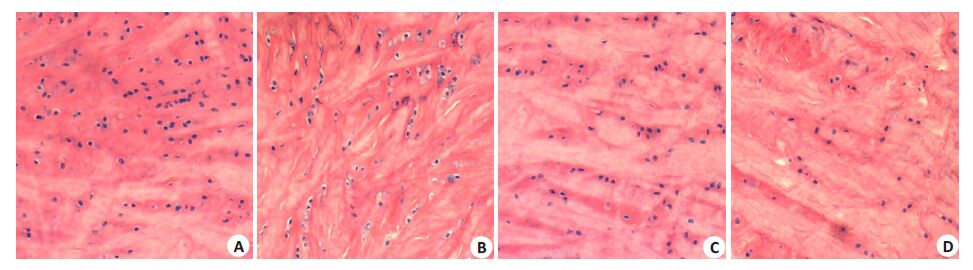
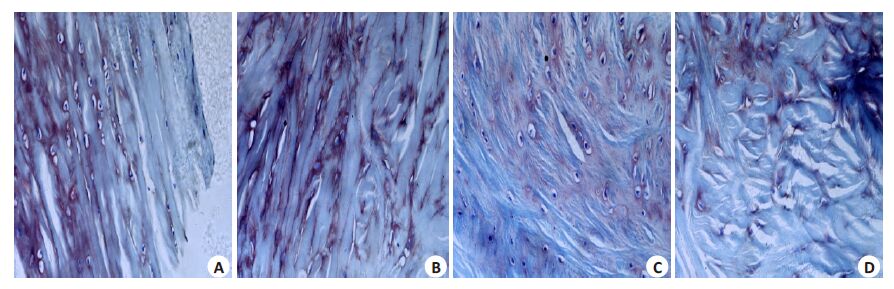
采用HE染色和甲苯胺蓝染色,按照Mankin评分法进行评定。(Mankin评分法:早期为1~5分、中期为6~ 9分、晚期为10~14分)。从图2、3和表2中可见N组软骨表面光滑、软骨细胞分布均匀、排列整齐、甲苯胺蓝染色均匀无失染、潮线完整、Mankin评分0~2分。M组软骨表层有裂隙、软骨细胞层次不清晰、排列无序、有成簇细胞出现、甲苯胺蓝染色深染、潮线不完整、Mankin评分7~9分。CN组软骨表面不规则、软骨细胞数量较少、 排列稍紊乱、轻度失染、潮线正常、Mankin评分3~5分。 NTN组软骨表面粗糙、软骨细胞排列紊乱、出现成簇细胞、轻度失染、潮线不完整、Mankin评分4~6分。从表2 可见,CN组和NTN组与M组相比软骨细胞分布较均匀,软骨缺损程度减轻、Mankin 评分显著降低(P< 0.01),CN组与NTN组相比细胞染色更均匀、细胞排列更整齐、层次清晰、Mankin评分进一步降低(P<0.01)。
|
图2 HE染色观察兔膝骨关节病理变化 Fig.2 Pathological changes of the knee joint of the rabbits observed with HE staining (Original magnification: ×200). A: Normal control group; B: Model group; C: Close-to-bone needling group; D: Normal thrust needing group. |
|
图3 甲苯胺蓝染色观察肥大细胞形态 Fig.3 Morphologic changes of the hypertrophic chondrocytes observed with Toluidine blue staining (Original magnification: × 200). A: Normal control group; B: Model group; C: Close-to-bone needling group; D: Normal thrust needing group. |
| 表2 各组关节软骨Mankin评分及Sox9、ColⅩ蛋白表达比较 Table 2 Comparison of Mankin score and Sox9 and ColX protein expressions in the cartilage in different groups (n=10, Mean±SD) |
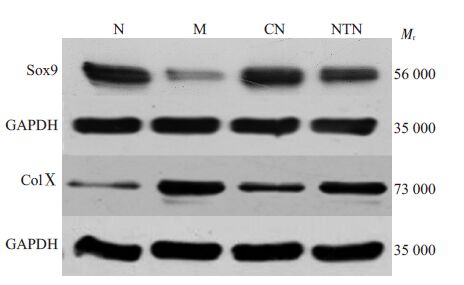
见图4、表2。与N组比较,M组Sox9蛋白表达量显著降低,ColⅩ蛋白表达量显著升高(P<0.01),CN组和NTN组Sox9蛋白表达量明显降低,ColⅩ蛋白表达量明显升高(P<0.01),与M组比较,CN组和NTN组Sox9蛋白表达量明显升高,ColⅩ蛋白表达量明显降低(P<0.01),CN组ColⅩ蛋白表达量较NTN组降低,两组比较差异有统计学意义(P<0.01)。
|
图4 各组Sox9和ColⅩ蛋白表达Western-Blot图 Fig.4 Sox9 and ColX protein expression detected by Western blotting. A: Normal control group; B: Model group; C: Close-to-bone needling group; D: Normal thrust needing group. |
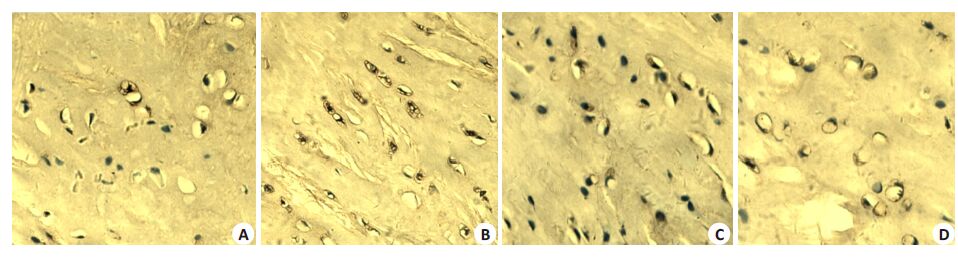
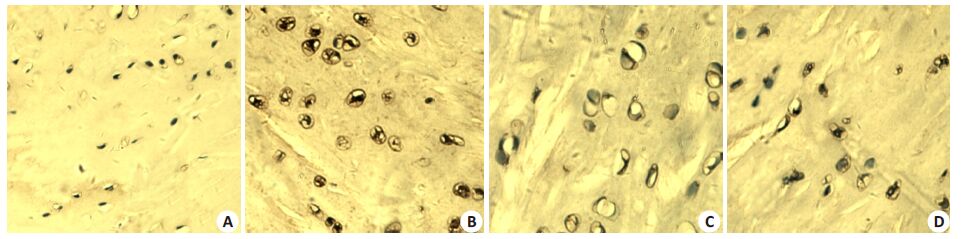
见图5、6和表3。VEGF和ColⅩ在M组中呈高阳性细胞表达,NTN组阳性细胞表达下降,且CN组下降的更加明显,N组中VEGF有少量阳性细胞,ColⅩ几乎没有显示阳性表达。与M组相比,CN 组和NTN 组VEGF和ColⅩ的阳性表达率明显下降,CN组的阳性表达率较NTN组下降更明显(P<0.01)。
|
图5 VEGF在组织中的表达 Fig.5 Expression of VEGF in the knee joint cartilage (Original magnification: ×200). A: Normal control group; B: Model group; C: Closeto- bone needling group; D: Normal thrust needing group. |
|
图6 ColⅩ在组织中的表达 Fig.6 Expression of ColX in the knee joint cartilage (Original magnification: ×200). A: Normal control group; B: Model group; C: Closeto- bone needling group; D: Normal thrust needing group. |
| 表3 各组VEGF、ColⅩ蛋白表达水平 Table 3 Protein expression levels of VEGF and ColX in the knee joint cartilage of the rabbits (n=10, Mean±SD) |
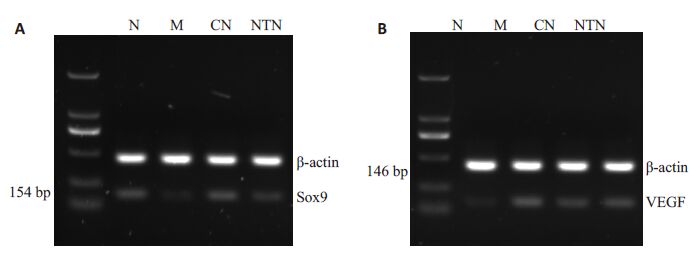
从图7,表4可知:与N组比较,M组、CN组和NTN 组Sox9 mRNA表达量明显降低,VEGF mRNA表达量明显升高(P<0.01);与M组比较,CN组和NTN组Sox9 mRNA表达量明显升高,VEGF mRNA表达量明显降低(P<0.01);而CN组Sox9 mRNA表达量也明显高于NTN组(P<0.01)。
|
图7 RT-PCR检测各组Sox9和VEGF mRNA的表达 Fig.7 Sox9 and VEGF mRNA expression detected by RT-PCR. A: Expression of Sox9 mRNA; B: Expression of VEGF mRNA. N: Normal control group; M: Modeling group; CN: Close-to-bone needling group; NTN: Normal thrust needing group. |
| 表4 各组Sox9和VEGFmRNA表达水平 Table 4 Expression of Sox9 and VEGF mRNA in the knee joint cartilage of the rabbits (n=10, Mean±SD) |
骨关节炎在中医中属于“骨痹”、“痹证”等范畴,《内经》提出“病在骨,骨重不可举,骨髓酸痛,寒气至,名曰骨痹”,点明了其病位在骨,病机主要为经络气血痹阻, 临床表现主要以关节疼痛、沉重为主要特点。临床观察发现,针刺膝关节周围穴位,特别是内外膝眼及足三里等穴,对疏通经脉、促进血液循环、减轻滑膜炎症和抗病镇痛有明显作用,针刺后接通电针仪进行电针治疗,接近人体生物电的低频脉冲电流有加强缓解肌肉和血管痉挛的作用[16]。《灵枢.官针》记载:“短刺者,刺骨痹,稍摇而深,致针骨,上下摩骨也”,其治法是稍摇动针以深入, 直达病痛深处,在近骨处上下提插。短是接近之意,故称为短刺,“短刺”作为古典刺法十二刺之一,主要治疗骨痹深部疾病。临床疗效观察:短刺配合温针灸可以活血消肿,通络止痛,有效恢复关节运动[17]、配合功能训练能显著改善膝关节功能障碍和疼痛程度[18],短刺法能深刺至骨缝,直达病所,其临床疗效显著[8],但目前在医学动物实验中尚未深入研究。
关节软骨主要由软骨细胞与细胞外基质组成,软骨细胞在分化过程中失去细胞正常表型,使固有的软骨细胞表型特征弱化,出现细胞去分化、肥大细胞终末分化及矿化等异常分化趋势,而这种紊乱的表型特征导致膝骨关节炎(KOA)软骨的修复机制处于无序状态,加速软骨基质的破坏[19]。Y染色体的性别决定区域(Sox9) 在软骨发生和发育过程中发挥极大的作用[20],是成软骨生长因子诱导成软骨分化过程中的“分子开关”和“关键节点”,研究表明Sox9在软骨细胞中过表达可抑制软骨细胞的肥大、延缓终末分化和骨化的过程[21, 22],Sox9能结合ColⅩ基因启动子直接激活该基因的表达,负向调控软骨细胞肥大进程[23],ColⅩ和ColⅪ、Ⅸ、Ⅱ等胶原纤维交织成网,为关节软骨提供必要的组织强度和应力[24],它主要存在于软骨细胞肥大区及钙化区,是肥大软骨细胞的标志性产物,在KOA的病变过程中,ColⅩ 阳性表达会向软骨纤维化区延伸[25],诱导基质矿化,分泌VEGF因子导致新生血管入侵,形成骨赘,VEGF是一种高度特异性的促血管内皮细胞生长因子,研究表明:VEGF对于破软骨细胞作用、细胞外基质重塑、软骨细胞死亡、血管生成及软骨板内软骨骨化都有调节作用[26],还可以通过作用于血管内皮细胞,促进新血管的形成,提高血管通透性,促进炎症的发展和形成[27]。所以提高Sox9和降低ColⅩ、VEGF的表达对抑制软骨细胞肥大以矿化、减轻炎症反应及修复软骨缺损至关重要。
针刺能刺激膝关节周围穴位,释放镇痛物质,缓解疼痛,改善局部血液循环,减轻滑膜炎症。短刺法通过缓慢进针,深刺至骨,直达病痛深处,与普通针刺法相比,能更明显改善关节活动、步态、局部肿胀和软骨的缺损程度,提高Sox9和降低ColⅩ、VEGF的表达。因此, 短刺法能通过抑制抑制软骨细胞肥大分化、维持正常的细胞表型、减轻炎症反应,使软骨组织得到修复,这可能是治疗KOA的另一机制通路,为临床短刺法治疗膝骨关节炎提供可靠的实验证据。
| [1] |
袁普卫, 杨威, 康武林, 等. 骨关节炎的康复治疗研究进展[J]. 风湿病与关节炎, 2016, 5(2): 63-7. ( 1) 1)
|
| [2] |
Glyn JS, Palmer AJ, Agricola R, et al. Osteoarthritis[J]. Lancet, 2015, 386(991): 376-87. ( 1) 1)
|
| [3] |
Courties A, Gualillo O, Berenbaum F, et al. Metabolic stressinduced joint inflammation and osteoarthritis[J]. Osteoarthritis Cartilage, 2015, 23(11): 1955-65. ( 1) 1)
|
| [4] |
Gao J, Ouyang BS, Zhang Y, et al. Comparison of the clinical therapeutic effects between electroacupuncture and warming needle moxibustion for knee osteoarthritis of kidney deficiency and marrow insufficiency pattern/syndrome [J]. Zhongguo Zhen Jiu, 2012, 32(5): 395-8. ( 1) 1)
|
| [5] |
Shen LL, Huang GF, Tian W, et al. Electroacupuncture inhibits chronification of the acute pain of knee osteoarthritis: study protocol for a randomized controlled trial[J]. Trials, 2015, 16(1): 131. ( 1) 1)
|
| [6] |
Ju Z, Guo X, Jiang X, et al. Electroacupuncture with different current intensities to treat knee osteoarthritis: a single-blinded controlled study[J]. Int J Clin Exp Med, 2015, 8(10): 18981-9. ( 1) 1)
|
| [7] |
伏秀霞. 短刺温针灸配合刺络拔罐治疗膝骨关节炎疗效观察[J]. 上海针灸杂志, 2011, 8(8): 564-5. ( 1) 1)
|
| [8] |
熊继发, 黄治庭. 短刺针法加电针治疗膝关节骨性关节炎36例疗效观察[J]. 河北中医, 2012, 34(4): 560-1. ( 2) 2)
|
| [9] |
Van Der Kraan PM, Van Den Berg WB. Chondrocyte hypertrophy and osteoarthritis: role in initiation and progression of cartilage degeneration[J]. Osteoarthritis Cartilage, 2012, 20(3): 223-32. ( 1) 1)
|
| [10] |
Liu CF, Lefebvre V. The transcription factors SOX9 and SOX5/ SOX6 cooperate genome-wide through super-enhancers to drive chondrogenesis[J]. Nucleic Acids Res, 2015, 43(17): 8183-203. ( 1) 1)
|
| [11] |
Studer D, Millan C, ?ztürk E, et al. Molecular and biophysical mechanisms regulating hypertrophic differentiation in chondrocytes and mesenchymal stem cells[J]. Eur Cell Mater, 2012, 24(4): 118-35; discussion 135. ( 1) 1)
|
| [12] |
Hulth A, Lindberg L, Telhag H. Experimental osteoarthritis in rabbits. Preliminary report[J]. Acta Orthop Scand, 1970, 41(5): 522-30. ( 1) 1)
|
| [13] |
段临涛, 王茜, 胡民华, 等. 超声与X线、MRI影像对膝骨关节炎的诊断价值分析[J]. 中国超声医学杂志, 2016, 32(3): 255-8. ( 1) 1)
|
| [14] |
Lequesne MG, Samson M. Indices of severity in osteoarthritis for weight bearing joints[J]. J Rheumatol Suppl, 1991, 27(8): 16-8. ( 1) 1)
|
| [15] |
Mankin HJ, Dorfman H, Lippiello L, et al. Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips. II. Correlation of morphology with biochemical and metabolic data[J]. J Bone Joint Surg Am, 1971, 53(3): 523-37. ( 1) 1)
|
| [16] |
常达, 王胜, 高珺. 针灸治疗膝骨性关节炎的临床研究近况[J]. 湖南中医杂志, 2016, 32(1): 182-4. ( 1) 1)
|
| [17] |
郭霖, 张海山. 短刺加温针灸治疗退行性膝关节炎临床研究[J]. 河南中医学院学报, 2008, 23(5): 64-5. ( 1) 1)
|
| [18] |
史中亚, 胡奋强, 陈勇. 短刺配合功能训练治疗膝骨关节炎疗效观察 [J]. 上海针灸杂志, 2012, 31(11): 826-8. ( 1) 1)
|
| [19] |
Chen S, Fu P, Cong R, et al. Strategies to minimize hypertrophy in cartilage engineering and regeneration[J]. Genes Dis, 2015, 2(1): 76-95. ( 1) 1)
|
| [20] |
廖军义, 周年, 林良波, 等. 联合表达BMP2和Sox9促进体外培养间充质干细胞成软骨分化[J]. 南方医科大学学报, 2014, 34(3): 317-22. ( 1) 1)
|
| [21] |
刘军, 王洪伟, 陈语, 等. SOX6和SOX9基因转染对人原发性骨关节炎关节软骨间充质祖细胞增殖和成软骨分化的调控作用[J]. 局解手 术学杂志, 2014, 23(5): 477-80, 481. ( 1) 1)
|
| [22] |
Liao J, Hu N, Zhou N, et al. Sox9 potentiates BMP2-induced chondrogenic differentiation and inhibits BMP2-induced osteogenic differentiation[J]. PLoS One, 2014, 9(2): e89025. ( 1) 1)
|
| [23] |
Dy P, Wang W, Bhattaram P, et al. Sox9 directs hypertrophic maturation and blocks osteoblast differentiation of growth plate chondrocytes[J]. Dev Cell, 2012, 22(3): 597-609. ( 1) 1)
|
| [24] |
Gu J, Lu Y, Li F, et al. Identification and characterization of the novel Col10a1 regulatory mechanism during chondrocyte hypertrophic differentiation[J]. Cell Death Dis, 2014, 5(10): e1469. ( 1) 1)
|
| [25] |
Shen G. The role of type X collagen in facilitating and regulating endochondral ossification of articular cartilage [J]. Orthod Craniofac Res, 2005, 8(1): 11-7. ( 1) 1)
|
| [26] |
Beckmann R, Houben A, Tohidnezhad M, et al. Mechanical forces induce changes in VEGF and VEGFR-1/sFlt-1 expression in human chondrocytes[J]. Int J Mol Sci, 2014, 15(9): 15456-74. ( 1) 1)
|
| [27] |
Maes C, Carmeliet P, Moermans K, et al. Impaired angiogenesis and endochondral bone formation in mice lacking the vascular endothelial growth factor isoforms VEGF164 and VEGF188[J]. Mech Dev, 2002, 111(1/2): 61-73. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
