2南方医科大学病理学系//广东省分子肿瘤病理学重点实验室,广东 广州 510515
2Department of Pathology, College of Basic Medical Sciences, Key Laboratory of Molecule Tumor Pathology of Guangdong Province, Guangzhou 510515, China
MicroRNAs(miRNAs)是一类长度约18-22 核苷酸的非编码小分子RNA家族,在转录后水平,通过碱基互补方式与靶向蛋白编码基因mRNA的3'UTR结合, 调控靶基因的表达,引起其降解或抑制其翻译;发挥着类似于癌或者抑癌基因的作用[1, 2, 3, 4, 5]。miRNAs调控着人类基因组中约1/3的蛋白编码基因,包括细胞增殖、分化、代谢、周期、凋亡及个体的发育等在内生命活动[6, 7]。 miR-101 属于miRNAs家族,存在于多种细胞中。成熟的miR-101有21个bp,在各个物种中,具有高度保守的成熟序列。研究表明,miR-101在多种实体肿瘤中如乳腺癌、前列腺癌、肺癌、垂体腺瘤、肝癌、胃癌、食管癌、卵巢上皮癌、胎儿型横纹肌肉瘤、胰腺癌、骨肉瘤等表达水平下调[5, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19]。miR-101可能参与肿瘤的发生、转移与侵袭等过程;并与患者的临床病理特征、生存预后及靶向治疗有关[6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17]。在实体肿瘤中,miR-101可能起着抑制肿瘤发生发展的作用[20]。研究表明miR-101和其靶基因在肿瘤细胞的增殖、分化、细胞周期、凋亡、迁移、侵袭转移以及其他过程中起着着一定的作用[1, 2]。miR-101 可抑制肝癌细胞的增殖;克隆形成及细胞周期的转录因子[4, 5]。研究发现,miR-101可抑制胃癌细胞的迁移,增殖能力[21]。在肺癌细胞中,miR-101 通过靶向调控CXCL12的表达而抑制肺癌细胞的增殖,迁移并促进肿瘤细胞凋亡[22]。在胰腺癌中,miR-101通过靶向作用于HMGA2 而抑制EMT 过程[18]。在骨肉瘤细胞中, miR-101靶向抑制c-FOS抑制肿瘤细胞的增殖、迁移和侵袭能力[19]。而本课题组前期研究发现,miR-101在低转移的SW480中表达较高,而在高转移SW620细胞中表达较低,成功构建稳定过表达miR-101 的细胞株SW620,并发现在结直肠癌细胞株中miR-101可靶向调控RACl表达[23]。miR-101可调控多种肿瘤细胞的生物学行为,而其对结直肠癌细胞SW620的生物学特性的影响的研究甚少,值得我们探讨。
1 材料和方法 1.1 细胞株结直肠癌细胞株SW620由本实验保存。稳定过表达miR-101 细胞株miR101-SW620 及其阴性对照GV209-SW620由本课题组前期构建[1]。
1.2 试剂RPMI 1640 培养基和胎牛血清均购自Hyclone。 CCK8试剂盒(日本同仁)购买于北京智杰方远科技有限公司,细胞周期试剂盒、细胞凋亡试剂盒均购买于南京凯基生物科技发展有限公司。
1.3 CCK-8细胞增殖实验取生长状态良好的细胞,消化后计数接种于96 孔板中,每孔细胞2000 个,每孔体积为100 μL,每组设置3 个复孔。待细胞贴壁后,使用CCK-8 试剂检测每一组的A值,以确保每孔细胞数比较一致。然后在每天同一时间点每孔加入10 μL CCK-8试剂后37 ℃孵育2 h,以blank 对照孔进行调零,使用GloMaxTM96 Microplate Luminometer发光检测仪测量其A值,用相对应的A值表示该组细胞增殖能力的大小。每组取3孔的平均值,并绘制增殖曲线,重复实验3次。
1.4 平板克隆形成实验取生长状态良好的细胞,用PBS液洗3次,然后用胰酶消化,反复吹打细胞悬液,制成单细胞悬液进行细胞计数,以每孔200个细胞密度接种于6孔板内,细胞培养21 d后,取出6孔板,吸去培养液,用PBS洗3次,空气干燥后用多聚甲醛固定15 min。然后使用苏木素染色20 min后用流水缓慢洗去染液,于空气干燥后肉眼计数其形成的克隆数(在显微镜下其细胞数目≥50个细胞作为一个克隆)。按照公式平板克隆的形成率=形成克隆数目/接种的细胞数目×100%分别计算其克隆形成率。
1.5 细胞周期分析取状态良好的细胞接种于6孔板内待细胞密度在80%以上时,弃去6孔板内的培养基,用预冷的PBS 清洗2 次,然后加入胰酶消化,待细胞收缩变圆的时候终止消化,轻柔吹打细胞使其成为单细胞悬液后将其加入1.5 mL EP 管中,2000 r/min,离心5 min,尽量将PBS去除。然后每个EP 管中加入70%冰乙醇500 μL固定细胞,置于4 ℃中过夜。第2 天拿出EP 管,于室温下1000 r/min,离心5 min,然后PBS 清洗2 次后,然后加入100 μL RNase A,置于37 ℃水浴30 min 后,再加400 μL的PI,将其混和均匀,4 ℃避光30 min。使用流式细胞仪上机检测,记录激发波长488 nm 处红色荧光, 每组设3 个复孔。
1.6 细胞凋亡实验取生长状态良好的细胞,接种于6孔板内,待细胞密度约80%时,然后吸去6孔板内的培养基,冷PBS洗2 次,然后用不含EDTA的胰酶进行消化细胞,收集细胞放置于EP 管内,用PBS洗涤细胞2次(2000 r/min离心5 min)收集1~5×105细胞,然后加入500 μL 1×Binding Buffer 悬浮细胞,然后加入1 μLAnneXinV-PE,轻轻地混匀后于4 ℃避光反应15 min,加入5 μL 7AAD,再次混匀,于4 ℃避光孵15 min,1 h 内使用流式细胞仪检测细胞凋亡的情况。
1.7 统计学处理采用SPSS13.0统计软件进行数据分析。CCK8及细胞周期分析值比较采用析因分析和单因素方差分析, 多重比较方差齐时采用LSD法、方差不齐时用Dunnett T3法。P<0.05 时,差异有统计学差异。
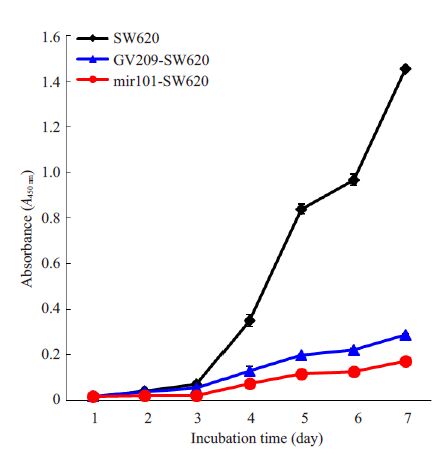
2 结果 2.1 CCK-8细胞增殖测定采用CCK-8 法检测过表达miR-101 后SW620 各组细胞的体外增殖能力的变化,并绘制生长曲线(表1, 图1)。析因方差分析结果显示:SW620细胞各组生长时间水平具有显著性差异(F=4152,P<0.05),组间具有显著性差异(F=10220,P<0.05),时间与组间交互效应有显著性差异(F=1825,P<0.000)。以上结果表明, 与空白组、对照组相比,miR101-SW620组的增殖速度明显降低,提示miR-101能抑制SW620细胞的体外增殖能力。
| 表1 CCK-8增殖实验检测miR-101对SW620细胞增殖的影响 Table 1 The effevtion of overexpression miR-101 on SW620 by CCK8 assays |
|
图1 miR-101过表达处理后SW620细胞的体外增殖情况 Fig.1 In vitro proliferation of SW620 cells with miR-101 over-expression. |
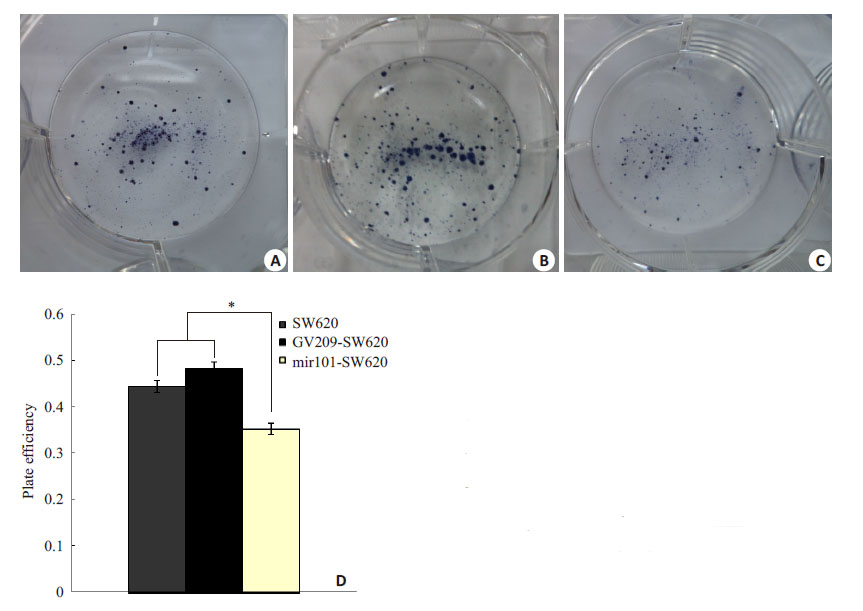
利用平板克隆形成实验检测过表达miR-101后细胞体外增殖能力的变化。平板克隆实验的结果为SW620空白对照组、GV209-SW620对照组和miR101- SW620 组的克隆形成率分别为:44.33%、48.17%、 35.17%。单因素方差分析结果显示SW620 3组细胞间的克隆形成能力差异具有统计学意义(F=73.015,P<0.001,图2)。与SW620空白对照组、GV209-SW620对照组相比,过表达miR-101 组细胞克隆形成率明显降低,表明过表达miR-101 后,可能抑制结直肠癌细胞SW620的增殖能力。
|
图2 miR-101 对SW620 细胞平板克隆形成能力的影响 Fig.2 Effect of miR-101 over-expression on plate colony formation of SW620 cells). A: SW620; B: GV209-SW620; C: mir101-SW620; D: Comparison of plate colony formation efficency among the 3 groups (*P<0.05). |
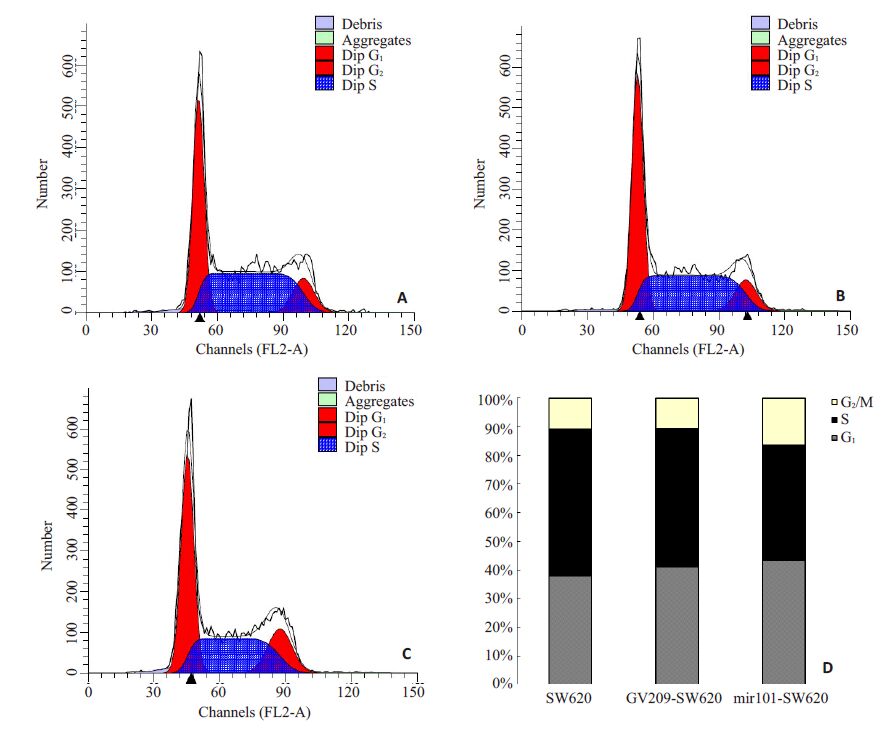
利用流式细胞仪技术检测分析过表达miR-101 后对结直肠癌细胞SW620 的细胞周期进程的影响(表2,图3)。细胞周期分析发现SW620各组细胞间其G1、S、G2/M期存在着统计学差异(F=45.974,P=0.019; F=122.139,P=0.000;F=115.171,P=0.000)。除了SW620 和GV209-SW620 的G2 期分布无统计学差异外(P= 0.441),其余各组G1、G2/M 期存在着统计学差异(P<0.01);与SW620和GV209-SW620相比,mir101-SW620 组出现了明显的G1和G2/M期周期阻滞。
| 表2 流式细胞仪分析过表达miR-101后对结直肠癌细胞SW620各组细胞周期的影响 Table 2 The effection to colorectal cancer cell cycle with overexpression miR-101 in SW620 by flow cytometry |
|
图3 流式细胞仪分析过表达miR-101后对结直肠癌细胞SW620周期的影响 Fig.3 Flow cytometry for analyzing the effect of miR-101 over-expression on cell cycles of SW620 cells. A: SW620; B: GV209-SW620; C: mir101-SW620; D: Comparison of cell cycle distribution among the 3 groups. |
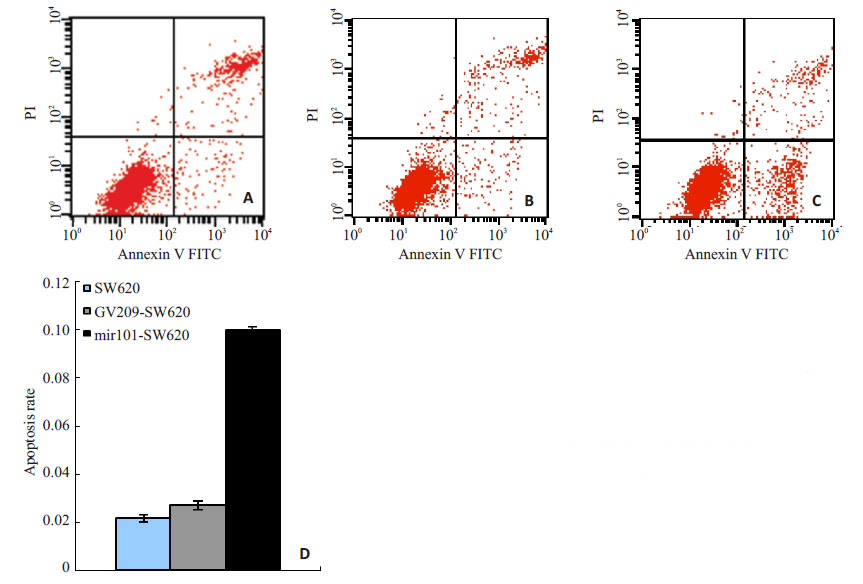
流式细胞仪检测过表达miR-101后SW620各组细胞凋亡的情况(图4)。细胞凋亡实验发现SW620、 GV209-SW620、miR101-SW620 细胞各组细胞凋亡率分别为(0.0217±0.0016)、(0.0270±0.0018)、(0.0999± 0.0015);差异有统计学意义(F=6115,P<0.05),各组进行两两比较,均有统计学差异(P<0.01)。与SW620空白细胞组、GV209-SW620对照组相比,miR-101过表达组细胞凋亡率增加(P<0.05)。
|
图4 过表达miR-101后对结直肠癌细胞SW620各组细胞凋亡的影响 Fig.4 Effect of over-expression of miR-101 on apoptosis of SW620 cells. A: SW620; B: GV209-SW620; C: mir101-SW620; D: Comparison of apoptotic cell rates among the 3 groups. |
miR-101 在乳腺癌、前列腺癌、肺癌、垂体腺瘤、 肝癌、胃癌、食管癌、卵巢上皮癌、胎儿型横纹肌肉瘤、胰腺癌、骨肉瘤、胆囊癌等多种实体肿瘤中表达水平下调,表明其可能与肿瘤的发生、转移、侵袭等过程相关,具有抑制肿瘤发生的作用[5, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24]。Wang 等[25]的研究表明,在胃癌细胞及其组织中miR-101 的表达均下调,并且与肿瘤的生长、侵袭和转移密切相关。有研究表明miR-101 下调EZH2 的表达抑制食管癌细胞的增殖、迁移能力、促进肿瘤细胞凋亡;通过靶向作用于CXCR7 而抑制乳腺癌细胞的增殖、侵袭能力,通过调控血管内皮生长因子C抑制肝癌细胞的迁移和侵袭[5, 14, 26]。本课题组在前期研究中利用慢病毒GV209-mir101 载体及其阴性对照载体转染结直肠癌细胞株SW620,从而实现了miR-101 的长期稳定表达,成功构建稳定过表达miR-101 的细胞株SW620,为进一步研究miR-101 对结直肠癌细胞生物学特性的影响提供了基础[23]。
本研究通过CCK8 细胞增殖实验、平板克隆实验发现miR-101 可能抑制结直肠癌细胞的增殖。 Strillaccia 等[27]研究发现,miR-101 在结肠癌患者的癌组织标本中表达明显低于其癌旁组织,高表达miR-101后可抑制结肠癌细胞的远处转移。Lin 等[28]发现miR-101 通过靶向作用于Rac1 抑制甲状腺乳头状癌细胞的生长,本课题组前期研究发现,在结直肠癌细胞株中miR-101 可靶向调RACl 的表达[23],表明miR-101 可能靶向调控RAC1 抑制结直肠癌细胞的生长,和Lin 等的研究结果一致。这提示miR-101 可能发挥着抑制结直肠癌发生的作用,其具体机制值得我们进一步探讨。
细胞周期结果表明,miR-101 可调控结直肠癌细胞周期,使其细胞出现了G1和G2/M 期周期阻滞。G1 期周期阻滞表明细胞的增殖速度减慢,提示miR-101 可能抑制结直肠癌细胞的增殖。放射治疗是治疗肿瘤病人的重要方式之一,而其效果如何,与肿瘤细胞周期分布密不可分,通常认为G2/M 期对放疗最为敏感,G1次之,S期最不敏感。细胞发生G2/M 期阻滞时将无法完成其DNA 损伤修复,从而引起G2/M 期阻滞延长,细胞的增殖能力下降,导致细胞增殖死亡[29]。 转移是结直肠癌患者死亡的主要原因,放射治疗对发生转移的患者具有一定的作用。过表达miR-101后细胞出现了明显的G2/M期周期阻滞,表明miR-101可能增加结直肠癌细胞的放疗敏感性,其是否能增强结直肠癌患者对放疗的敏感性,延长患者预后值得我们进一步探讨。细胞凋亡实验表明,miR-101 可能促进结直肠癌细胞的凋亡。研究表明在食管癌、卵巢上皮癌、胎儿型横纹肌肉瘤、肝癌及侵袭性子宫内膜癌等肿瘤细胞中,miR-101 通过下调EZH2 的表达而抑制肿瘤细胞的增殖、迁移能力,促进细胞凋亡,并可以促进肿瘤细胞对化疗药物的敏感性[14, 15, 16, 30, 31]。miR-101 是否能增强结直肠癌对化疗敏感性及其及其分子机制, 值得进一步研究。
本研究通过CCK-8增殖实验、平板克隆形式实验, 细胞周期和凋亡实验,发现了miR-101可能抑制结直肠癌细胞SW620的增殖、细胞G1、G2/M周期阻滞,促进细胞凋亡。有文献报道miR-101 并可通过调控PI3K/ AKT/mTOR 信号通路抑制胃癌细胞的细胞活力、克隆形成、迁移侵袭能力并促进肿瘤细胞的凋亡[32]。Bao等[24] 发现miR-101 通过调控MAPK/Erk 及Smad 信号通路抑制胆囊癌的转移和侵袭。Chandramouli等[27, 33]发现在结直肠癌细胞中,miR-101可在转录后水平调控EP4 受体和Cox-2的表达从而调节肿瘤的发生发展。在结直肠癌细胞中,miR-101的缺失可以通过Wnt/β-catenin 信号通路促进结直肠癌细胞的恶变[34]。而我们在前期研究发现miR-101 可靶向调控结直肠癌细胞株RACl 的表达,本研究发现miR-101可能抑制结直肠癌细胞的生物学行为[23]。这表明miR-101 可能通过靶向调控RAC1的表达参与调控结直肠癌细胞的生物学行为,抑制结直肠癌的发生发展及浸润转移。RAC1是癌基因, 与肿瘤的发生、转移、侵袭、细胞凋亡、周期调控和肿瘤新生血管的形成密切相关,参与PI3K-Rac1-JNK、 NF-κB-JNK等信号通路[35, 36, 37, 38]。为进一步探讨miR-101 在结直肠癌的发生发展、浸润转移的分子机制及靶向治疗制提供了一定的理论依据。而在临床应用中, miR-101是否可能增强结直肠癌患者对放化疗的敏感性,并成为结直肠癌患者靶向治疗及预后的生物学指标值得进一步探讨。
| [1] |
Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-97. ( 3) 3)
|
| [2] |
Esquela-Kerscher A, Slack FJ. Oncomirs-microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4): 259-69. ( 2) 2)
|
| [3] |
Manikandan J, Aarthi JJ, Kumar SD, et al. Oncomirs: the potential role of non-coding microRNAs in understanding cancer [J]. Bioinformation, 2008, 2(8): 330-4. ( 1) 1)
|
| [4] |
Yi H, Hua-Chien C, Chao-Wei C, et al. Identification of atwo-layer regulatory network of proliferation-related microRNAs inhepatoma cells[J]. Nucleic Acids Res, 2012, 40(20): 10478-93. ( 2) 2)
|
| [5] |
Liu ZY, Wang JJ, Mao YQ, et al. MicroRNA-101 suppresses migration and invasion via targeting vascular endothelial growth factor-C in hepatocellular carcinoma cells[J]. Oncol Lett, 2016, 11 (1, A): 433-8. ( 5) 5)
|
| [6] |
Lim LP, Glasner ME, Yekta S, et al. Vertebrate MicroRNA genes[J]. Science, 2003, 299(5612): 1540. ( 2) 2)
|
| [7] |
Silahtaroglu A, J SJ. MicroRNAs,epigenetics and disease[J]. Essays Biochem, 2010, 48(1): 165-85. ( 2) 2)
|
| [8] |
Iorio MV, Ferracin M, Liu CG, et al. MicroRNA gene expression deregulation in human breast cancer[J]. Cancer Res, 2005, 65(16): 7065-70. ( 3) 3)
|
| [9] |
Mattie MD, Benz CC, Bowers J, et al. Optimized high-throughput microRNA expression profiling provides novel biomarker assessment of clinical prostate and breast cancer biopsies[J]. Mol Cancer, 2006, 5: 24. ( 3) 3)
|
| [10] |
Yanaihara N, Caplen N, Bowman E, et al. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J]. Cancer Cell, 2006, 9(3): 189-98. ( 3) 3)
|
| [11] |
Bottoni A, Zatelli MC, Ferracin M, et al. Identification of differentially expressed microRNAs by microarray: a possible role for microRNA genes in pituitary adenomas[J]. J Cell Physiol, 2007, 210(2): 370-7. ( 3) 3)
|
| [12] |
Su H, Yang JR, Xu T, et al. MicroRNA-101, down-regulated in hepatocellular carcinoma, promotes apoptosis and suppresses tumorigenicity[J]. Cancer Res, 2009, 69(3): 1135-42. ( 3) 3)
|
| [13] |
He XP, Shao Y, Li XL, et al. Downregulation of miR-101 in gastric cancer correlates with cyclooxygenase-2 overexpression and tumor growth[J]. FEBS J, 2012, 279(22): 4201-12. ( 3) 3)
|
| [14] |
Chen L, Fei H, Li QZ, et al. miR-101 suppresses tumor proliferation and migration, and induces apoptosis by targeting EZH2 in esophageal cancer cells[J]. Int J Clin Exp Pathol, 2014, 7(10): 6543-50. ( 5) 5)
|
| [15] |
Liu L, Guo JF, Yu LL, et al. miR-101 regulates expression of EZH2 and contributes to progression of and cisplatin resistance in epithelial ovarian cancer[J]. Tumor Biology, 2014, 35(12): 12619- 26. ( 4) 4)
|
| [16] |
Vella S, Pomella S, Leoncini PP, et al. MicroRNA-101 is repressed by EZH2 and its restoration inhibits tumorigenic features in embryonal rhabdomyosarcoma[J]. Clin Epigenetics, 2015, 7(1): 82. ( 4) 4)
|
| [17] |
Caponi S, Funel N, Frampton AE, et al. The good, the bad and the ugly: a tale of miR-101, miR-21 and miR-155 in pancreatic intraductal papillary mucinous neoplasms[J]. Ann Oncol, 2013, 24 (3): 734-41. ( 3) 3)
|
| [18] |
Jiang W, Gu W, Qiu R, et al. miRNA-101 suppresses epithelialto- mesenchymal transition by targeting HMGA2 in pancreatic cancer cells[J]. Anticancer Agents Med Chem, 2016, 16(4): 432-9. ( 3) 3)
|
| [19] |
Wang ZL, He RZ, Xia HS, et al. MicroRNA-101 has a suppressive role in osteosarcoma cells through the targeting of c-FOS[J]. Exp Ther Med, 2016, 11(4): 1293-9. ( 3) 3)
|
| [20] |
Friedman JM, Jones PA, Liang G. The tumor suppressor microRNA-101 becomes an epigenetic player by targeting the polycomb group protein EZH2 in cancer[J]. Cell Cycle, 2009, 8 (15): 2313-4. ( 2) 2)
|
| [21] |
Liu HT, Xing AY, Chen X, et al. MicroRNA-27b, microRNA-101 and microRNA-128 inhibit angiogenesis by down-regulating vascular endothelial growth factor C expression in gastric cancers [J]. Oncotarget, 2015, 6(35): 37467-79. ( 2) 2)
|
| [22] |
Zhang J, Liu J, Liu Y, et al. miR-101 represses lung cancer by inhibiting interaction of fibroblasts and cancer cells by downregulating CXCL12[J]. Biomed Pharmacother, 2015, 74: 215-21. ( 1) 1)
|
| [23] |
刘燕, 陆滟霞, 周敏, 等. 稳定过表达mir-101结直肠癌细胞株的建立及其靶基因的鉴定[J]. 南方医科大学学报, 2014, 43(7): 928-33. ( 4) 4)
|
| [24] |
Bao RF, Shu YJ, Hu YP et al. miR-101 targeting ZFX suppresses tumor proliferation and metastasis by regulating the MAPK/Erk and smad pathways in gallbladder carcinoma[J]. Oncotarget, 2016 Mar 8. doi: 10.18632/oncotarget.7970.[Epub ahead of print]. ( 2) 2)
|
| [25] |
Wang HJ, Ruan HJ, He XJ, et al. MicroRNA-101 is down-regulated ingastric cancer and involved in cell migration and invasion[J]. Eur J Cancer, 2010, 46(12): 2295-303. ( 1) 1)
|
| [26] |
Li JT, Jia LT, Liu NN, et al. MiRNA-101 inhibits breastcancer growth and metastasis by targeting CX chemokine receptor 7[J]. Oncotarget, 2015, 6(31): 30818-30. ( 1) 1)
|
| [27] |
Strillacci A, Griffoni C, Sansone P, et al. MiR-101 downregulation is involved in cyclooxygenase-2 overexpression in human colon cancer cells[J]. Exp Cell Res, 2009, 315: 1439-47. ( 2) 2)
|
| [28] |
Lin XJ, Guan HY, Hai L, et al. miR101 inhibits cell proliferation by targeting Rac1 in papillary thyroid carcinoma[J]. Biomed Rep, 2014, 2(1): 122-6. ( 1) 1)
|
| [29] |
Gupta VK, Park JO, Jaskowiak NT, et al. Combined gene therapy and ionizing radiat ion is a novel approach to treat human esophageal adenocarcinoma[J]. Ann Surg Oncol, 2002, 9(5): 500-4. ( 1) 1)
|
| [30] |
Xu LB, Beckebaum S, Iacob S, et al. MicroRNA-101 inhibits human hepatocellular carcinoma progression through EZH2 downregulation and increased cytostatic drug sensitivity[J]. J Hepatol, 2014, 60(3): 590-8. ( 1) 1)
|
| [31] |
Konno Y, Dong PX, Xiong Y, et al. MicroRNA-101 targets EZH2, MCL-1 and FOS to suppress proliferation, invasion and stem cell-like phenotype of aggressive endometrial cancer cells[J]. Oncotarget, 2014, 5(15): 6049-62. ( 1) 1)
|
| [32] |
Riquelme I, Tapia O, Leal P, et al. miR-101-2, miR-125b-2 and miR-451a act as potential tumor suppressors in gastric cancer through regulation of the PI3K/AKT/mTOR pathway[J]. Cell Oncol, 2016, 39(1): 23-33. ( 1) 1)
|
| [33] |
Chandramouli A, Onyeagucha BC, Mercado-Pimentel ME, et al. MicroRNA-101(miR-101)post-transcriptionally regulates the expression ofEP4 receptor in colon cancers[J]. Cancer Biol Ther, 2012, 13(3): 175-83. ( 1) 1)
|
| [34] |
Strillacci A, Griffoni C, Sansone P, et al. MiR-101 downregulation is involved in cyclooxygenase-2 overexpression in human colon cancer cells[J]. Exp Cell Res, 2009, 315(8): 1439-47. ( 1) 1)
|
| [35] |
Sanliongiu S, Luleci G, Thomas KW. Simultaneous inhibition of Rac1 and IKK pathways sensitizes lung cancer cells to TNFalphamediated apoptosis[J]. Cancer Gene Ther, 2001, 8(11): 897-905. ( 1) 1)
|
| [36] |
Hahn A, Barth H, Kress M, et al. Role of Rac and Cdc42 in lysoohosphatidicacid-mediated cyclo-oxygenase-2 gene expression [J]. Biochem J, 2002, 362(Pt 1): 33-40. ( 1) 1)
|
| [37] |
Chan AY, Coniglio SJ, Chuang YY, et al. Roles of the Rac1 and Rac3 GTPases in human tumor cell invasion[J]. Oncogene, 2005, 24 (53): 7821-9. ( 1) 1)
|
| [38] |
Xuan YH, Chi LS, Tian HS, et al. The activation of the NF-kappa B-JNK pathway is independent of the PI3K-Rac1-JNK pathway involved in the bFGF-regulated human fibroblast cell migration[J]. J Dermatol Sci, 2016, 82(1): 28-37. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
