2上海市杨思医院内分泌科,上海 200126
2Department of Endocrinology and Metabolism, Yangsi Hospital, Shanghai 200126, China
骨质疏松症(OP )是以骨量低下,骨组织微结构破坏为特征导致骨脆性增加而易骨折的全身代谢性骨病。它是危及老年人特别是绝经后妇女健康问题之一。近年研究发现人甲状旁腺激素(PTH)类药是目前最有前途的骨形成促进剂,不但能逆转骨质疏松性骨丢失,间歇性低剂量给予PTH能使骨量增加,促进骨形成[1]。临床用药有重组人PTH全长型hPTH和N末端片段hPTH(1-34)活性片段,后者具有PTH 相同的生理作用[1]。
PTH对骨代谢的调节作用机制有多种,有PKA[2]和丝裂原活化蛋白激酶(MAPKs)/细胞外调节蛋白激酶(ERKs)通路[3, 4]等信号通路,PTH 可能通过调节基质GLA蛋白(MGP)对骨代谢起调节作用[4, 5, 6]。MGP是软骨内骨形成和血管内钙化的重要调节因子,是矿盐沉积的重要抑制物[7, 8, 9, 10, 11]。Wnt/β-catenin 信号通路也在骨形成中起重要的作用[12],PTH能结合Wnt/β-catenin 信号通路的重要因子Runx2的启动子而正调控Runx2的转录[13]。PTH、MGP及Wnt/β-catenin 信号通路之间的关系对理解PTH在促进成骨细胞分化、生成的作用机制有重要价值。
本研究采用体外培养的人成骨肉瘤细胞MG63,用不同浓度PTH(1-34)进行干预,观察MGP、Wnt/ β-catenin信号传导通路相关因子的表达水平变化,通过检测骨代谢活力标记物ALP活性来观察成骨细胞的成骨活动,并用Wnt/β-catenin 信号传导通路特异抑制剂DKK-1 干预对照,阐明PTH、MGP及Wnt/β-catenin 信号通路之间的关系,阐明PTH(1-34)促进骨生成的作用分子机制。
1 材料和方法 1.1 试剂无酚红DMEM(Gibco);0.25%胰酶(含EDTA) (Gibco);青霉素-链霉素抗生素(Gibco);胎牛血清(Gibco);PTH(1-34)(Sigma);DKK-1(Sigma);MGP、 β-catenin、Runx2、LRP5、GAPDH 引物( 上海Invitrogen);Premix Ex TaqTM(Perfect Real Time)(日本TaKaRa);PrimeScript? RT reagent Kit(Perfect Real Time)(TaKaRa);Trizol(TaKaRa);兔抗MGP多克隆抗体(Abcam);鼠抗β-catenin 多克隆抗体(Abcam);鼠抗Runx2 单克隆抗体(Abcam);兔抗LRP5 多克隆抗体(Abcam);鼠抗β-actin单克隆抗体、山羊抗小鼠IgG 二抗,HRP 辣根过氧化物酶标记、鼠抗兔IgG 二抗,HRP 辣根过氧化物酶标记(北京全式金公司);蛋白抽提试剂盒(北京碧云天公司);PVDF膜(Millipore);发光试剂盒(Millipore),碱性磷酸酶活力试剂盒(南京建成公司)。
1.2 细胞培养及药物干预人成骨肉瘤细胞株MG63细胞购买于美国培养保存中心(ATCC号:CRL-1427)。取成骨肉瘤细胞MG63 细胞株复苏,用含有10%FBS+1%青-链霉素的无酚红DMEM培养液,置于含5% CO2、37 ℃培养箱中培养, 细胞处于对数生长期时,按5×105/瓶接种于25 cm2培养瓶,细胞培养液每2 d 更换1 次。当细胞汇合度达80%左右时进行药物干预:(1)实验分为3 组干预组(10-9 mol/L PTH、10-8 mol/L PTH、10-7 mol/L PTH)及空白对照组;(2)实验分为PTH组:10-7 mol/L PTH(1-34); PTH + DKK-1 组:10-7 mol/L PTH(1-34)+ 200 ng/mL DKK-1;DKK-1组:200 ng/mL DKK-1;空白对照组:无酚红DMEM,分别于24 h 后提取各组总mRNA(按Trizol操作说明进行),48 h后提取各组总蛋白。
1.3 碱性磷酸酶(ALP)活性检测用矿化诱导液[DMEM(H)+10%FBS+10 mmol/L β-甘油磷酸钠+0.1 μmol/L地塞米松+50 μg/mL VitC]培养细胞,同时按前述分组加入PTH及Dkk-1干预细胞, 2~3 d换液1次,连续诱导7 d,按碱性磷酸酶染色及活力检测试剂盒说明书进行染色及活力测定。
1.4 荧光实时定量PCR(qPCR)检测mRNA表达按照试剂盒(PrimeScript@RTreagent Kit, TaKaRa)要求操作,按份配置逆转录反应液(反应液配置在超净台内在冰上进行)。引物设计和合成:管家基因GAPDH 作为内参基因,根据Genenbank 数据库,由Primer express5.0 软件设计、上海Invitrogen 公司合成MGP、β-catenin、LRP5、Runx2和GAPDH 引物,引物序列见表1。根据最终的优化体系,内参基因和目的基因进行Real-Time PCR 反应。
1.5 Western blot检测蛋白表达按蛋白提取试剂盒说明书提取细胞总蛋白,进行Western blot。应用Quantity One软件对电泳条带扫描的灰度值进行Western blotting实验结果的数据分析。
1.6 统计学分析用IBM SPSS Statistics 20 统计软件进行数据分析,计量资料以均数±标准差表示,比较两组如果方差齐用t检验,方差不齐用秩和检验,多组间比较用ANOVA 方差分析。P<0.05 为差异有统计学意义。
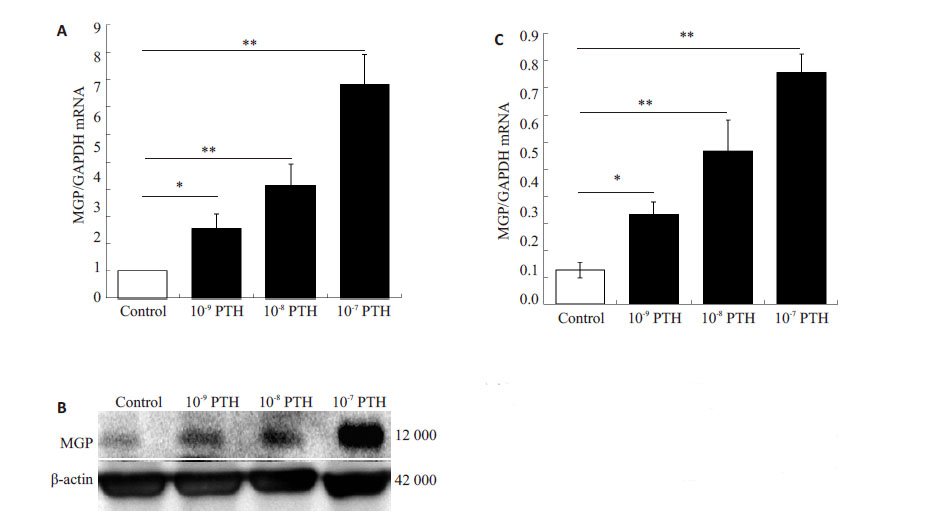
2 结果 2.1 PTH上调MG63细胞MGP表达,且呈剂量依懒性用10-9、10-8、10-7 mol/L PTH分别处理MG63 24 h, 用RT-PCR方法检测MGP mRNA的表达量发现,MGP mRNA的表达分别是对照组的2.56倍、4.14倍、7.81倍(P<0.01,图1A)。同时我们用Western-blot方法检测细胞裂解液中MGP蛋白(12 000)含量,结果显示3种浓度PTH(10-9、10-8、10-7 mol/L)均相应地促进MGP蛋白的表达,且呈剂量依赖性增高,10-9 mol/L PTH组与对照组相比,P<0.05;10-8 mol/L PTH组、10-7 mol/L PTH组与对照组相比(P<0.01,图1B、C)。
|
图1 PTH上调MG63细胞MGP Fig.1 PTH up-regulates MGP expression in MG 63 cells. A: RT-PCR results (**P<0.01 vs control); B: Western blotting results; C: Quantitative analysis of Western blotting results of three independent experiments (*P<0.01, **P<0.05). |
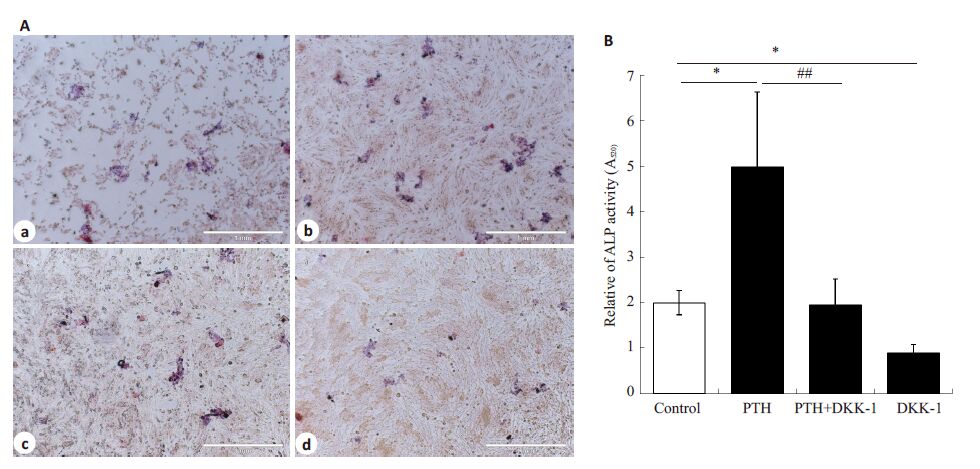
根据上述实验,我们选择10-7 mol/L浓度的PTH进一步研究PTH处理MG63细胞是否对成骨细胞的生成有促进作用。ALP是成骨细胞成骨活动相关的一个重要指标。药物Dkk-1是Wnt/β-catenin 信号通路的特异抑制剂。经过矿化诱导液处理的MG63 细胞,10-7 mol/L PTH、200 ng/mL Dkk-1、PTH+Dkk-1分别处理细胞,观察1周后ALP活性状态。如图2A所示,碱性磷酸酶染色(偶氮偶联法)显示细胞内蓝色为ALP活性部分,红色为细胞核。与经过矿化但无药物处理的对照组(图2A-a)相比,PTH组ALP活性部分明显增加(图2A-b),而Dkk-1组(图2A-c)相对减少,Dkk-1与PTH联合作用时(图2A-d),与PTH组相比ALP活性部分明显减少(图2A);与对照组相比,PTH明显增加ALP活力,Dkk-1明显降低ALP 活力(*P<0.05),PTH 与Dkk-1 联合作用时,PTH促细胞ALP活力的作用被抑制(与PTH组相比,##P<0.01,图2B)。
|
图2 矿化诱导的MG63细胞经过PTH处理后碱性磷酸酶活性升高 Fig.2 PTH increases alkaline phosphatase (ALP) activity in mineralization solution-treated MG63 cells. A: ALP was stained by Azo coupling method (Original magnification: ×40; a-d: Control, PTH, DKK, and PTH+DKK treatment groups, respectively). ALP was stained blue and the nucleus red; B: ALP ratio of treatment group relative to the control (##P<0.01, *P<0.05). |
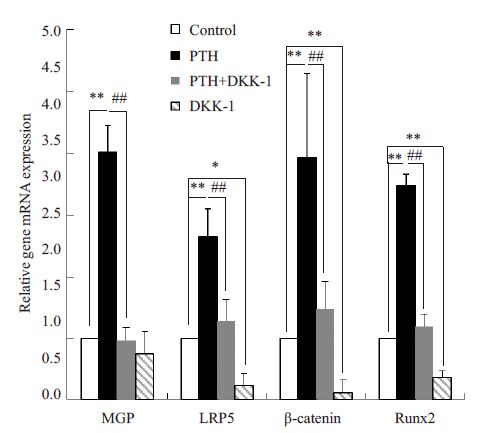
MGP、Wnt/β-catenin 通路LRP5、β-catenin 及Runx2 基因表达情况。如图3所示,在用10-7 mol/L PTH作用于MG63 细胞24 h 后,Wnt/β-catenin 经典信号通路LRP5、β-catenin 及Runx2 mRNA的表达均上调,分别是对照组的2.65、4.01、3.48倍(P<0.05,P<0.01),Dkk-1 使LRP5、β-catenin 及Runx2 mRNA 的表达下降(P<0.05,P<0.01),但Dkk-1 并未明显抑制MGP mRNA的表达,差异无统计学意义(P>0.05),而PTH与Dkk-1联合作用时,Dkk-1 的抑制作用抵消了PTH 促MGP、 LRP5、β-catenn、Runx2的作用(P<0.05,P<0.01)。
|
图3 PTH处理MG63细胞对wnt/β-catenin信号通路相关分子mRNA表达的影响 Fig.3 Effect of PTH treatment on mRNA expressions in wnt/ β-catenin pathway in MG63 cells. *P<0.05, **P<0.01; #P<0.05, ##P<0.01. |
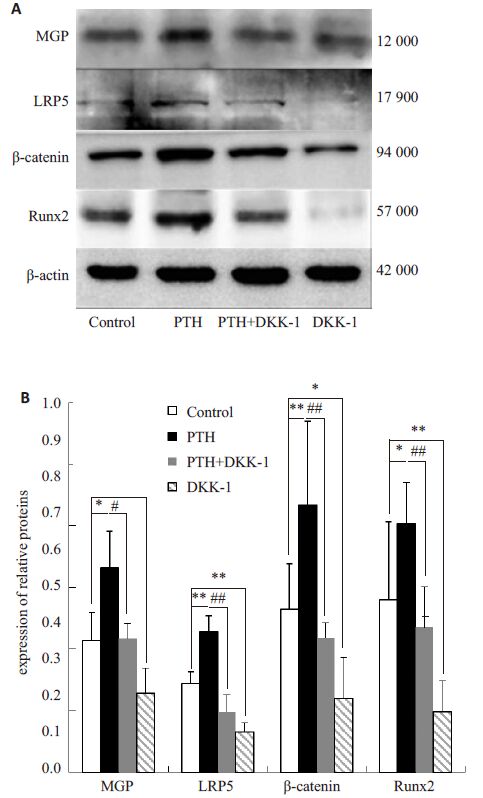
进一步对以上各组细胞裂解液进行Western-blot 分析发现,PTH对MGP及wnt/β-catenin经典信号通路LRP5、β-catenin及Runx2蛋白的表达的影响与基因一致,PTH促进了这些蛋白的表达,Dkk-1则抑制LRP5、 β-catenin 及Runx2 蛋白的表达,差异均有统计学意义(P<0.05,P<0.01),但与对照组相比MGP蛋白的表达无明显差异(P>0.05),PTH与Dkk-1联合作用能阻断PTH 的作用,与PTH组相比,MGP、LRP5、β-catenn、Runx2 蛋白的表达均减少(P<0.05,P<0.01,图4)。
|
图4 PTH对MG63细胞的wnt/β-catenin经典信号通路相关分子蛋白表达水平的影响 Fig.4 PTH treatment effect on the protein expressions in wnt/β-catenin pathway in MG63 cells. A: Western blot analysis of the protein expressions; B: Quantitative analysis of the results of three independent experiments. *P<0.05, **P<0.01; #P<0.05, ##P<0.01. |
PTH是一种调节钙磷代谢、维持机体钙稳态的主要激素,PTH(1-34)作为抗骨质疏松用药已经在临床上使用。PTH调节骨代谢机制有很多报道,近年来对PTH 与MGP及Wnt/β-catenin 信号通路对促进骨的形成与分化有很多研究进展,但它们之间的关系有很多待阐明。本研究从以下几个方面进一步探讨了它们之间的关系。
本研究进一步在体外培养的MG63 细胞中证实PTH正调控了MGP的表达。MGP是一种维生素K依赖性循环蛋白,它广泛存在于骨骼、牙质、软骨、心、 肺等组织中[7]。敲除MGP基因和转基因过表达MGP的小鼠研究显示MGP是软骨内骨形成和血管内钙化的重要调节因子,是矿盐沉积的重要抑制物[9, 10]。在体内,MGP主要受许多骨代谢相关的蛋白或因子调节, PTH、钙、磷、维生素D、雌激素等均能影响或调节MGP的表达[8, 14]。向小鼠颅骨注射PTH会使MGP的mRNA的表达增加2 倍[15]。Gopalakrishnan 等[16]发现PTH 呈时间和剂量依赖性诱导成骨细胞MC3T3-E1 的MGP 表达。我们研究小组也发现在原代培养SD 大鼠成骨细胞中使用PTH、维生素K2、活性维生素D3、阿仑膦酸盐均能诱导MGP mRNA的表达,且呈剂量依赖性[11]。本研究显示在我们使用的浓度范围内(分别是10-9、10-8、10-7 mol/L),PTH(1-34)刺激MGP表达呈剂量依赖性,PTH浓度越高,MGP表达越高(图1)。我们的研究与Gopalakrishnan 等[16]在MC3T3-E1 成骨样细胞的实验结果一致,也与我们课题组在去卵巢SD大鼠上的实验相符合[6]。
我们证实PTH 促进了人成骨细胞ALP 的活性(图2)。碱性磷酸酶同工酶3(ALP3)是骨源性碱性磷酸酶(NBAP),是成骨细胞的表型标记物之一,它可直接反应成骨细胞的活力或功能状况。我们研究结果和张秀珍等研究相符,他们在一项多中心研究数据显示绝经后骨质疏松患者在rhPTH(1-34)治疗后第6个月,第12个月和18个月骨形成指标-骨碱性磷酸酶显著增加, 并在12个月内向峰值接近,12个月后,上升减慢,他们认为rhPTH打开了骨生长窗,促使骨形成加速[17]。我们检测Wnt/β-catenin 信号通路在促进成骨中的作用。
DKK-1 是真核细胞分泌型糖蛋白,能与Wnt 的受体LRP-5、LRP-6结合,从而阻断Wnt/β-catenin信号通路, 影响成骨细胞分化[18],在实验中常作为Wnt/β-catenin信号通路的抑制剂。当使用DKK-1 组干预MG63 细胞后,ALP活性明显减少,而PTH和DKK-1联合使用时, DKK-1 能抵消PTH 的一部分作用,但不能完成阻断PTH 的作用。我们的结果说明PTH 在调节Wnt/ β-catenin信号通路影响成骨细胞的代谢和活性的重要作用,也提示PTH对其他通路的作用。 我们检测了PTH及DDK-1 单独用药及联合用药对MGP及WNT通路的各组分的mRNA及蛋白表达水平。结果显示PTH(1-34)10-7 mol/L 干预MG63 细胞24 h后,MGP、Wnt/β-catenin信号通路LRP5、β-catenin 及Runx2的mRNA和蛋白水平都较对照组升高,同时相应表达的蛋白较对照组增多。用Wnt/β-catenin信号通路的抑制剂DDK-1后MGP的mRNA及蛋白表达和对照组相比,没有统计学差别,但LRP5、β-catenin 及Runx2的表达均比对照组降低,而PTH及DDK-1的联合用药时,PTH的作用明显被DDK-1抵消,但没有完全抑制。这些结果说明PTH调节MGP作用主要不是通过Wnt/β-catenin信号通路,这一结果与Fazenda 等[13]及Suttamanatwong等[15]文献报道的报道有出入,前者认为PTH通过Runx2促进了MGP的表达,后者认为Runx2 对MGP的调节有双重作用。结果不同的原因之一可能是因为每个实验所用的细胞不同造成。因此,我们这一结果还需要进一步在MGP基因过表达及敲除实验中验证,并在更多的骨细胞株中研究。虽然如此,MGP的升高本身会对骨代谢起作用,如Kulkarni等[19, 20]作了类似报道,即PTH通过上调MGP影响骨代谢,促进成骨细胞分化与形成,而PTH通过Wnt/β-catenin信号通路对骨代谢的调节起着重要的作用。有研究发现PTH能结合Runx2的启动子并促进Runx2的转录[15],本研究结果显示,PTH 不但促进了Runx2 表达,也促进了Wnt/ β-catenin信号通路的LRP5和β-catenin的表达,因此可对下游的Runx2表达起到加强作用,Runx2表达增加刺激成骨细胞生长,降低成熟成骨细胞凋亡[21, 22, 23]。
我们的结果显示DDK-1 不能完全抑制PTH 对ALP的作用及Wnt/β-catenin作用,除开PTH调节MGP 的作用以外,其他的原因还与PTH还通过其它机制参与骨代谢的作用有关。例如Yamashita等[2]认为当PTH 与成骨细胞表面跨膜G蛋白偶联受体结合,激活细胞内PKA和PKC通路,导致Runx2-PKA活性增加,从而促进胰岛素样生长因子-1和胰岛素样生长因子-2及成纤维细胞生长因子基因表达,从而促进成骨细胞的分化、 增值,并激活抗凋亡基因Bcl-2 的转录阻止其凋亡。 Datta等[3]研究表明丝裂原活化蛋白激酶/细胞外调节蛋白激酶通路也参与PTH-R1受体对骨形成的调节。
本研究证明PTH(1-34)可诱导体外培养的成骨细胞MG63的内源性MGP的表达,及Wnt/β-catenin信号通路的LRP5、β-catenin及Runx2等主要组分的表达,从而促进成骨细胞ALP活力,促进成骨作用。PTH(1-34) 可通过上调Wnt/β-catenin 信号通路及增加MGP活性促进成骨细胞分化。
| [1] |
陈家伦. 临床内分泌学[M]. 上海: 上海科学技术出版社, 2011: 1479-82. ( 1) 1)
|
| [2] |
Yamashita J, Datta NS, Chun Y-HP, et al. Role Df Bcl2 jn osteoclastogenesis and PTH anabolk actions in bone[J]. Bone Miner Res, 2008, 23(7): 621-32. ( 2) 2)
|
| [3] |
Datta NS, Abou-Samra AB. PTH and PTHrP signaling in osteoblasts [J]. Cell Signal, 2009, 21(8): 1245-54. ( 2) 2)
|
| [4] |
Khoshniat S, Bourgine A, Julien M, et al. Phosphate-dependent stimulation of MGP and OPN expression in osteoblasts via the ERK1/2 pathway is modulated by Calcium[J]. Bone, 2011, 48(4): 894-902. ( 1) 1)
|
| [5] |
谢菲飞, 杨雅, 赖晓阳. 维生素D 对基质GLA蛋白的影响[J]. 中国 骨质疏松杂志, 2015, 9: 1123-7, 1142. ( 1) 1)
|
| [6] |
赖晓阳, 陈雪英, 方向南, 等. 甲状旁腺激素对去卵巢SD大鼠及其成 骨细胞基质GLA蛋白表达的影响[J]. 中华内分泌代谢杂志, 2012, 28 (4): 330-4. ( 6) 6)
|
| [7] |
Price PA, Williamson MK. Primary structure of bovine matrix Gla protein, a new vitamin K-dependent bone protein[J]. J Biol Chem, 1985, 260(28): 14971-5. ( 2) 2)
|
| [8] |
Fusaro M, Giannini S, Gallieni M, et al. Calcimimetic and vitamin D analog use in hemodialyzed patients is associated with increased levels of vitamin K dependent proteins[J]. Endocrine, 2016, 51(2): 333-41. ( 2) 2)
|
| [9] |
Luo G, Ducy P, Mckee MD, et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein[J]. Nature, 1997, 386(6620): 78-81. ( 2) 2)
|
| [10] |
Marulanda J, Gao C, Roman H, et al. Prevention of arterial calcification corrects the low bone mass phenotype in MGPdeficient mice[J]. Bone, 2013, 57(2): 499-508. ( 2) 2)
|
| [11] |
赖晓阳, 方向南, 陈雪英, 等. 四种骨质疏松治疗药物对原代SD大鼠成骨细胞MGP表达的影响[J]. 中华内分泌代谢杂志, 2012, 28(12): 956-61. ( 2) 2)
|
| [12] |
Burgers TA, Williams BO. Regulation of Wnt/β-catenin signaling within and from osteocytes[J]. Bone, 2013, 54(2): 244-9. ( 1) 1)
|
| [13] |
Fazenda C, Sim?es B, Kelsh RN, et al. Dual transcriptional regulation by runx2 of matrix Gla protein in Xenopus laevis[J]. Gene, 2010, 450(1/2): 94-102. ( 2) 2)
|
| [14] |
Gopalakrishnan R, Suttamanatwong S, Carlson AE, et al. Role of matrix Gla protein in parathyroid hormone inhibition of osteoblast mineralization[J]. Cells Tissues Organs, 2005, 181(3-4): 166-75. ( 1) 1)
|
| [15] |
Suttamanatwong S, Jensen ED, Schilling J, et al. Sp proteins and Runx2 mediate regulation of matrix gla protein (MGP) expression by parathyroid hormone[J]. J Cell Biochem, 2009, 107(2): 284-92. ( 3) 3)
|
| [16] |
Gopalakrishnan R, Ouyang H, Somerman MJ, et al. Matrix gamma-carboxyglutamic acid protein is a key regulator of PTHmediated inhibition of mineralization in MC3T3-E1 osteoblast-like cells[J]. Endocrinology, 2001, 142(10): 4379-88. ( 2) 2)
|
| [17] |
张秀珍, 宣淼, 李颖, 等. 一项为期18个月、多中心应用重组人甲状旁腺激素(1-34)与依降钙素治疗绝经后骨质疏松症的随机、对照临床试验研究[J]. 中华内分泌代谢杂志, 2015, 31(2): 120-6. ( 1) 1)
|
| [18] |
MacDonald BT, JoIner DM, Oysemlan SM, et al. Bone mass is inversely propor -tional to DKK-1 levelsinmice[J]. Bone, 2007, 41 (5): 331-9. ( 1) 1)
|
| [19] |
Kulkarni NH, Halladay DL, Miles RR, et al. Effects of parathyroid hormone on Wnt signaling pathway in bone[J]. J Cell Biochem, 2005, 95(6): 1178-90. ( 1) 1)
|
| [20] |
Wan M, Yang C, Li J, et al. Parathyroid hormone signaling through low-density lipoprotein-related protein 6[J]. Genes Dev, 2008, 22 (21): 2968-79. ( 1) 1)
|
| [21] |
Marie PJ, Kassem M. Osteoblasts in osteoporosis: past, emerging, and future anabolic targets[J]. Eur J Endocrinol, 2011, 165(1): 1-10. ( 1) 1)
|
| [22] |
Gao J, Liu Q, Liu X, et al. Cyclin G2 suppresses estrogen-mediated osteogenesis through inhibition of Wnt/β-catenin signaling[J]. PLoS One, 2014, 9(3): e89884. ( 1) 1)
|
| [23] |
Iyer S, Ambrogini E, Bartell SM, et al. FOXOs attenuate bone formation by suppressing Wnt signaling[J]. J Clin Invest, 2013, 123 (8): 3409-19. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
