南方医科大学南方医院,2放疗科,广东 广州 510515
2Department of Radiation Oncology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
肝细胞性肝癌(下称肝癌)是我国常见的恶性肿瘤之一[1]。目前肝癌治疗仍然以外科手术切除或肝移植为主,但由于该病起病隐匿,多数患者确诊时已处于中晚期,而失去了手术治疗时机。因此,发现和鉴定可用于肝癌早期诊断的分子指标,对提高肝癌的早诊率和加强患者的预后有着重要的临床意义。
微小RNA(miRNA)是一类内源性非编码RNA,长度为18~25个核苷酸。近年来的研究表明其在多种肿瘤中均与肿瘤发生、发展、复发、转移等密切相关,发挥着癌基因及抑癌基因的功能[2, 3]。miRNA作为新兴的生物标志物逐步受到研究者的关注,并且有望成为肿瘤诊断标志物及治疗的潜在靶点。
已有研究表明miR-107在多种实体肿瘤中异常表达,其异常表达与肿瘤的发生发展密切相关,并可作为判断不良预后的分子指标。但是,目前的研究表明, miR-107在不同的肿瘤中发挥相反的作用。例如,在肾透明细胞癌中,miR-107表达下调,发挥抑癌基因的作用,且与肿瘤的大小、侵袭、转移呈负相关[4]。然而,在结肠癌中,其表达上调,发挥着癌基因的作用,且与肿瘤的不良预后呈正相关关系[5]。由此推测,miR-107发挥作用可能具有组织或肿瘤依赖性。在肝癌中miR-107的研究报道较少,因此,本研究拟探讨miR-107 在肝癌组织中的表达及临床意义,并初步探讨miR-107在肝癌中的作用机制。
1 资料和方法 1.1 样本收集 1.1.1 组织标本的来源收集2009年9月~2012年10月在南方医科大学南方医院接受肝癌切除手术治疗的22 例肝癌患者的肝癌及相应癌旁组织标本。收集南方医院病理科2005年9月~2010年8月石蜡包埋的53例肝癌组织标本。所有患者术前均未行放射、化疗及射频消融等治疗,且所有组织标本经术后病理学检查均证实为肝细胞性肝癌。
1.1.2 临床资料石蜡包埋的53例患者中,男性41例, 女性12例,年龄>55岁22例,年龄≤55岁31例。TNM 分期为I~Ⅱ期47例,Ⅲ~Ⅳ期6例。肿瘤大小>5 cm 34 例,肿瘤大小≤5 cm 19 例。肝外转移3 例,未转移50 例。复发20例,无复发33例。
1.2 材料人肝癌细胞株Huh7 购自中国科学院上海细胞库;胎牛血清、高糖DMEM 培养基、培养基购自GIBCO;胰蛋白酶消化液购自吉诺公司;Lipofectamine RNAiMAX、TRIzol Reagent 购自Invitrogen;SYBR? PrimeScriptTMRT-PCR Kit(Perfect Real Time)购自TAKARA;miR-107特异性引物、内参U6引物由上海英潍捷基公司合成;miR-107 模拟物(mimics), AGCAGCAUUGUACAGGGCUAUCA、AUAGCCC UGUACAAUGCUGCUUU及对应阴性对照(negative control,nc),序列:UUCUCCGAACGUGUCACGUT T、ACGUGACACGUUCGGAGAATT 和抑制剂(inhibitor),序列:UGAUAGCCCUGUACAAUGCUG CU,对应阴性对照(negative control,nc),序列:CAGU ACUUUUGUGUAGUACAA由上海吉玛公司合成;四氮唑蓝(MTT)粉末、二甲基亚砜(DMSO)购自Sigma 公司。
1.3 方法 1.3.1 数据组基因数据来源:TCGA 数据集(TCGA cohort)来源于TCGA 数据库(https://tcga-data.nci. Nih.gov/tcga/),数据包含372个肝癌组织样本及50个癌旁组织样本。GSE6857 数据集(GSE6857 cohort)、 GSE10694数据集(GSE10694 cohort)、GSE21362数据集(GSE21362 cohort)来源于GEO 数据库(http:// www.Ncbi.Nlm.nih.gov/geo)。GSE6857 数据集由Xin Wei Wang提交,包括241对肝癌样本[6];GSE 10694 数据集由Li W提交,包括78对肝癌样本及10例正常肝样本[7];GSE21362数据集由Akira Myomoto 提交,包括73对肝癌样本[8]。
1.3.2 细胞培养人肝癌细胞株Huh7采用含10%胎牛血清的高糖DMEM培养基培养,置于37 ℃、5% CO2培养箱内培养,倒置显微镜下观察细胞生长情况,2~3 d用胰酶消化、传代培养,取生长状态良好的细胞用于实验。
1.3.3 实时定量RT-PCR(qRT-PCR)按照说明书步骤用Trizol 提取收集细胞、肝癌组织及癌旁组织中的总RNA,对A260/A280 在1.8~2.0 之间的RNA标本进行逆转录,利用PrimeScript 逆转录PCR(RT-PCR)试剂盒将总RNA 逆转录出miR-107 和U6 snRNA(作内参)的cDNA。我们用SYBR Premix PCR试剂盒按照说明书进行实时定量PCR实验,所有实验重复3次。我们用delta- CT求基因相当表达量方法[9]分析miRNAs的表达水平。
1.3.4 miR-107 mimics 和inhibitor 的转染按照说明书我们用Lipofectamine RNAiMAX 转染试剂转染miR-107 mimics和inhibitor入肝癌细胞中。在转染12 h 前先将细胞铺到6 孔板中。每孔先将50 pmol miR- 107 mimics(inhibitor)或阴性对照序列与4 μL LipofectamineRNAiMAX分别加至250 μL Opti-MEM 中孵育5 min,然后将两者轻轻混合,室温孵育20 min后加入到各个孔中。在培养箱中培养48 h即可进行下一步实验。
1.3.5 细胞增殖实验细胞增殖活力是根据四氮唑比色实验即MTT实验来测定。转染24 h后,细胞分两组(nc 组,inhibitor 和mimics 组)进行消化,用DMEM培养基重悬制成单细胞悬液,铺96 孔板,每孔800 个细胞96 孔板的左上孔设为空白孔,只加培养基,不加MTT 及细胞,用于设备调零,每组设6个复孔。细胞贴壁后每天同一时间用一块板,每孔加20 μL浓度为5 mg/mL 的MTT试剂,细胞再避光培养4 h。然后去上清,用100 μL DMSO溶甲瓒沉淀,37 ℃振摇孵育10 min。最后在酶标仪上测定各孔490 nm的吸光度A值。
1.4 统计分析所有计量数据采用均数±标准差表示,采用SPSS20.0 统计软件进行分析,样本均数的比较采用Student's t检验,双侧P<0.05为差异有统计学意义。
2 结果 2.1 miR-107在肝细胞癌组织中表达上调TCGA 及GEO 肝癌microRNA 表达谱数据结果示,miR-107在肝细胞癌组织中表达显著高于其在癌旁组织中的表达(P<0.05,图1)。22 对新鲜肝癌组织中miR-107 表达的检测结果验证了以上数据库结果(P< 0.05,图2)。
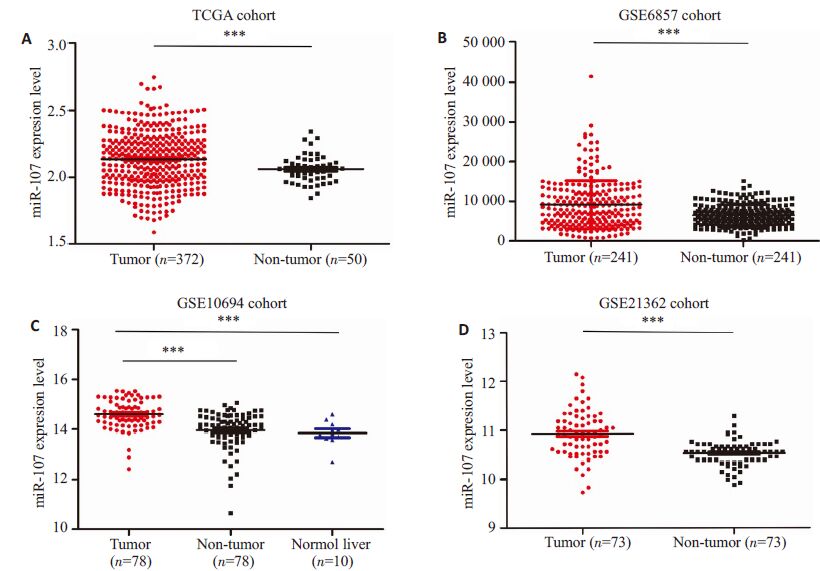
|
图1 miR-107 在数据库中肝细胞癌组织及癌旁组织中的表达水平比较 Fig.1 Expression levels of miR-107 in HCC tissues. A: miR-107 expression in TCGA cohort; B: miR-107 expression in GSE6857 cohort; C: miR-107 expression in GSE10694 cohort; D: miR-107 expression in GSE21362 cohort. ***P<0.05 vs normal tissues. |
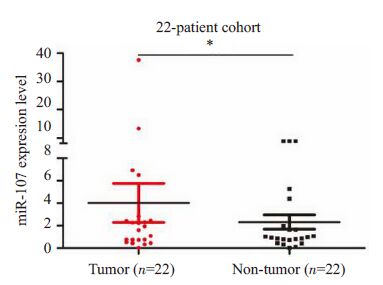
|
图2 miR-107 在肝细胞癌组织及对应癌旁组织中的表达水平比较 Fig.2 Expression Levels of miR-107 in 22 pairs of human HCC tissues and adjacent noncancerous tissues. *P<0.05 vs normal tissues. |
研究发现在肝癌患者中,miR-107表达水平与肿瘤的大小(P=0.032)呈正相关,而与患者性别(P=0.156)、 年龄(P=0.378)、肝硬化水平(P=0.615)、甲胎蛋白水平(P=0.279)、门静脉癌栓(P=0.31)、巴塞罗那分期(P=0.058)、肿瘤性质(P=0.607)、是否复发(P=0.292)、是否转移(P=0.982)尚未发现有相关性(表1)。
| 表1 肝癌组织中miR-107的表达与临床病理参数的关系 Table 1 Correlation between miR-107 expression and clinicopathologic features of the HCC patients |
用Huh7细胞过表达miR-107后,细胞增殖能力明显增强。相反,沉默miR-107后,细胞增殖能力明显减弱(P<0.05,图3)。
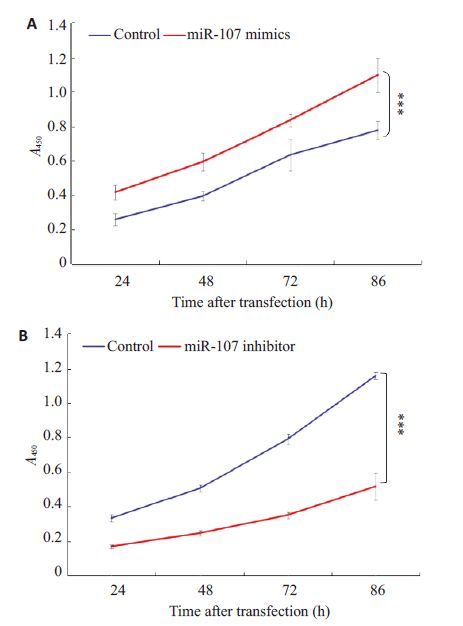
|
图3 上调(下调)miR-107 的表达促进(抑制)肝癌细胞的增殖 Fig.3 Transient transfection of miR-107 mimics (A) and inhibitor promoted and inhibited the cell proliferation of HCC cell line, respectively, shown by the results of MTT assay. Data are shown as Mean ± SD from 3 independent experiments. ***P<0.05 vs nc. |
目前的研究表明,许多miRNA 在肿瘤组织中表达失调,并且呈现肿瘤组织特异性的表达方式。 miRNA的这个特点为其在肿瘤的诊断和治疗的应用提供了新的途径。miR-107 位于人类10 号染色体,其在肿瘤中呈现过高或过低表达,发挥着癌基因和抑癌基因的作用。例如,其在结肠癌高表达,而在肾癌中低表达[4, 5]。因此,深入探讨miR-107在不同肿瘤中的作用有着非常重要的意义。本文主要探讨其在肝癌中的表达及初步探讨其作用机制。我们利用TCGA及GEO数据库中肝癌microRNA表达谱数据进行统计分析,结果提示miR-107在肝癌组织中高表达。提示异常表达的miR-107可能在肝癌中发挥着癌基因的作用。
本研究进一步利用qRT-PCR方法检测了22 对新鲜肝癌及其对应的癌旁组织中miR-107的表达情况,也发现miR-107在肝癌组织中高表达,结果与之前数据库分析一致。为了更深入地探讨miR-107在肝癌中的临床意义,我们进一步分析了53例石蜡包埋的肝癌组织miR-107的表达水平与肝癌临床病理特征间的相关性, 发现miR-107 与肿瘤大小呈正相关。以上结果提示miR-107可能与肝癌细胞的增殖能力相关。为了证明这一点,我们选取肝癌细胞株Huh7细胞进行过表达和沉默后检测其增殖能力,结果表明miR-107可增强肝癌细胞增殖能力。这与Jun-Hong Hu等报道miR-107促进hepG2细胞增殖的结果相一致[10],然而,贾振亚等曾报miR-107可抑制hepG2细胞的增殖[11]。本研究首先从临床分析中得到miR-107与肿瘤大小呈正相关,并且体外实验证实其具有促进增殖作用。我们猜测这可能由于细胞生物学特性及下游靶基因的不同所致,也可能是贾振亚等的研究结果仅局限在细胞水平所致。
综上所述,本研究对TCGA及GEO数据集、新鲜肝癌标本、石蜡标本,肝癌细胞株等多个方面进行研究分析,发现miR-107 可能是一个肝癌发生发展相关的基因。提示,miR-107可能成为肝癌治疗的新的靶点,也可能成为观察肝癌快速增殖的一个新指标。然而本文也存在一些不足,如样本量少,未进行体内实验以及未进行靶基因的探讨。我们下一步将采取加大样本量和体内动物实验的方法来深入探讨miR-107在HCC中的生物学作用、机制及临床意义。
| [1] |
中国抗癌协会肝癌专业委员会, 中国抗癌协会临床肿瘤学协作专业委员会. 中华医学会肝病学分会肝癌学组. 原发性肝癌规范化诊治的专家共识[J]. 中华肝脏病杂志, 2009, 17(6): 403-10. ( 1) 1)
|
| [2] |
Sayed D, Abdellatif M. Micrornas in development and disease[J]. Physiol Rev, 2011, 91(3): 827-87. ( 1) 1)
|
| [3] |
Farazi TA, Hoell JI, Morozov P, et al. MicroRNAs in human cancer [J]. Adv Exp Med Biol, 2013, 774(4): 1-20. ( 1) 1)
|
| [4] |
Song N, Ma X, Li H, et al. microRNA-107 functions as a candidate tumor suppressor gene in renal clear cell carcinoma involving multiple genes[J]. Urol Oncol, 2015, 33(5): 205. e1-11. ( 2) 2)
|
| [5] |
Chen HY, Lin YM, Chung HC, et al. miR-103/107 promote metastasis of colorectal cancer by targeting the metastasis suppressors DAPK and KLF4[J]. Cancer Res, 2012, 72(14): 3631-41. ( 2) 2)
|
| [6] |
Budhu A, Roessler S, Zhao X, et al. Integrated metabolite and gene expression profiles identify lipid biomarkers associated with progression of hepatocellular carcinoma and patient outcomes[J]. Gastroenterology, 2013, 144(5): 1066-1075. e1. ( 1) 1)
|
| [7] |
Li W, Xie L, He X, et al. Diagnostic and prognostic implications of microRNAs in human hepatocellular carcinoma[J]. Int J Cancer, 2008, 123(7): 1616-22. ( 1) 1)
|
| [8] |
Sato F, Hatano E, Kitamura K, et al. MicroRNA profile predicts recurrence after resection in patients with hepatocellular carcinoma within the Milan Criteria[J]. PLoS One, 2011, 6(1): e16435. ( 1) 1)
|
| [9] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-8. ( 1) 1)
|
| [10] |
Zhang JJ, Wang CY, Hua L, et al. miR-107 promotes hepatocellular carcinoma cell proliferation by targeting Axin2[J]. Int J Clin Exp Pathol, 2015, 8(5): 5168-74. ( 1) 1)
|
| [11] |
贾振亚, 曹静, 范文洁, 等. miR-107对HepG2细胞增殖和细胞周期的影响[J]. 安徽医科大学学报, 2014(10): 1400-3, 1404. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
