2南方医科大学第五附属医院//肝胆乳腺外科,广东 广州 510900
2Department of Hepatobiliary and Breast Surgery, Fifth Affiliated Hospital of Southern Medical University, Guangzhou 510900, China
结直肠癌(colorectal cancer,CRC)是一种严重威胁人类生命健康的恶性肿瘤,结直肠癌在我国的发病率居肿瘤类第3位,与此同时,我国结直肠癌病人的5年生存率为47.2%,而美国为65%[1]。结直肠癌的治疗目前仍以外科手术为主,辅以放、化疗及生物治疗。AT模体结合因子1(AT motif binding factor 1,ATBF1)是Morinaga等[2]从人肝癌细胞HuH-7中完整分离出了一个全长cDNA编码的蛋白与人甲胎蛋白基因增强子AT 富集元件相结合,ATBF1包括4个同源结构域和23个锌指结构,多个在调控转录的片段[3]。
ATBF1不仅仅与肿瘤的发生、发展相关,同时还有许多重要的生物学效应[4]。其中常见的生物学效应有乳腺腺体发育[5]、神经细胞分化[6]、抗氧化应激[7]、高碳酸血症中免疫抑制[8]、抑制细胞IL-6 介导的细胞应答[9] 等。ATBF1在肝癌、胃癌、乳腺癌、前列腺癌、头颈部鳞状细胞癌等肿瘤中均表现出重要的生物学效应,其中研究表明ATBF1在前列腺癌中为第2常见突变基因[10]。
但是ATBF1 基因对结直肠癌的发生相关研究极少,ATBF1蛋白在结直肠癌中的表达情况及其与结直肠癌的临床病理特征之间的关系并未有相关报道,同时国内外尚无有关ATBF1蛋白在结直肠癌细胞株中表达情况的报道,因此有必要对ATBF1在结直肠癌中所起的作用进行研究探讨,进一步明确ATBF1的在结直肠癌中表达情况及其与结直肠的发生、发展的关系。
1 资料和方法 1.1 资料收集南方医科大学珠江医院及南方医科大学南方医院2012年2月~2013年2月间146 例结直肠癌患者的癌组织及癌旁组织。其中男性74 例,女性72例,平均年龄61.13 岁,62例伴有淋巴结转移。所有患者手术前均未经放疗、化疗及生物治疗。新鲜组织标本取材过程在组织标本离体后不超过10 min立即将组织标本放入液氮中,然后放入-80 ℃冰箱中保存备用。所有病例的病理诊断均经过两名副主任以上医师进行阅片复诊,包括组织学类型、分级、淋巴结转移情况等。其临床及病理资料分别来自病案室及病理科。其中确诊为中分化结直肠癌患者癌组织38例和相应患者的癌旁组织38 例标本用于ATBF1mRNA表达量检测。本研究将研究对象分为两组:转移组和非转移组。获得患者及家属知情同意和南方医科大学珠江医院及南方医院伦理委员会批准。
本研究所采取的LoVo、HCT116、LS174T、SW620、 SW480细胞株均来自于南方医科大学生理实验室。
1.2 主要试剂ATBF1 兔抗人单克隆抗体(美国Abcam 公司)、 S-P 免疫组化试剂盒(北京中杉金桥生物技术开发有限公司)、DAB 显色试剂盒(北京中杉金桥生物技术开发有限公司)、Alexa Fluor 594,驴抗兔IgG 二抗, (Invitrogen 公司)、Trizol Reagent(Invitrogen 公司)、蛋白提取试剂盒(南京凯基NO.KGP250)、蛋白定量试剂盒试剂盒(南京凯基NO. 23227)、Trizol Reagent (Invitrogen 公司)、Prime ScriptTM RT reagent Kit with gDNA Eraser(TAKARA 公司)、SYBR? Premix Ex TaqTM II(TAKARA公司)。
1.3 实验方法LOVO细胞株、HCT116 细胞株、LS174T细胞株、 SW620细胞株、SW480细胞株用10%胎牛血清DMEM 高糖培养液,0.25%胰酶加0.02%EDTA消化,放置在37 ℃的二氧化碳恒温箱内孵育。
1.3.1 免疫组织化学将病理标本从液氮中取出,取大小2 cm×1.5 cm×0.2 cm的组织制备石蜡切片。运用免疫组织化学S-P法检测ATBF1的表达情况。随机选择100个细胞,在每部分5个典型的区域内随机选择2个实验组独立观察。采用半定量积分法判断,阳性<5%为0 分,6%~25%为1 分,26%~50%为2 分,51%~75%为3 分,>75%为4分。染色强度呈淡黄色为1分,黄色为2 分,棕黄色为3 分。阳性细胞比和染色强度两项积分相乘,0 分为(-),1~4 分为(+),5~8 分为(++),9~12 分为(+++)。
1.3.2 激光共聚焦将各细胞株用共聚焦皿爬片成功后,使用4%多聚甲醛固定,用Triton 进行破膜处理, 1%BSA封闭完毕后用1抗10 μL(rabbit polyclonal Ab 9 1∶100,abcam,ab119909)进行孵育,用1%BSA稀释的二抗(Alexa Fluor 594,1∶150,驴抗兔IgG 二抗, invitrogen,)进行杂交,使用5 μg/mL DAPI染色后使用激光共聚焦显微镜观察并拍照。
1.3.3 免疫印迹取100 mg组织,制备组织匀浆,RIPA 裂解液裂解细胞,BCA法行蛋白定量(按照凯基全蛋白抽提试剂(KGP250)步骤对各细胞株进行总蛋白提取)。提取成功后按照试剂盒:PierceTM BCA Protein Assay Kit(NO. 23227)步骤进行蛋白定量。取30 μg总蛋白,SDS-PAGE 电泳分离,电转移至PVDF 膜,1% BSA室温封闭1 h,一抗、二抗孵育,洗膜,ECL显影,暗室中定影后摄片,扫描胶片,以ImageJ软件分析目的蛋白和内参照蛋白条带灰度值,目的蛋白相对表达量以ATBF1/GAPDH表示。
1.3.4 Real time RT-PCR取100 mg组织,制备组织匀浆,抽提总RNA(将各细胞株培育完成后,采Ttrizol一步法提取总RNA)。定量后逆转录为cDNA,行real time PCR,操作步骤参照试剂盒说明书,运用Livak法变化形式用参照基因的ΔCT 法方法计算出目的基因的表达量,以ATBF1/β-actin GAPDH表示。
1.3.5 统计学分析实验数据通过整理后,应用SPSS14.0统计软件进行统计分析,应用秩和检验、卡方检验验证结直肠癌中ATBF1的表达情况与临床病理参数之间的关系,以P<0.05为差异有统计学意义。
2 结果 2.1 本研究所纳入的146例结直肠患者临床病例特征本研究将纳入患者分为转移组和转移组,所有纳入患者术前均未进行放、化疗及生物治疗。转移组和非转移组中患者年龄、性别、肿瘤位置、肿瘤大小之间的差别均无统计学意义。所纳入患者临床病理特征如表1,2所示。
| 表1 引物设计 Table 1 Primer design |
| 表2 146例结直肠癌患者的临床病理特征 Table 2 Clinical data of 146 patients with colorectal cancer |
如表3 所示,在结直肠癌组织中ATBF1 的阳性率仅为56.2%,而癌旁组织中ATBF1的阳性率为82.9%; 经统计学分析两组差别有显著统计学意义(P<0.05)。 即ATBF1蛋白在癌旁组织中的表达量明显高于在癌组织中的表达量。结直肠癌中ATBF1蛋白的表达。在转移组中ATBF1 蛋白的表达量(50%)低于非转移组(67.86%),但ATBF1蛋白的表达与性别、肿瘤位置、T、 N分期关系不明显(P>0.05)。
| 表3 癌组织及癌旁组织中ATBF1的表达与临床病理特征的关系 Table 3 Expression of AT motif-binding factor 1 (ATBF1) protein in primary tumors and adjacent tissues of colorectal cancer and relation with clinicopathological feature |
如图1、表3所示:低分化癌组织中ATBF1表达率为33.33%,中分化癌组织中ATBF1表达率为59.83%, 高分化癌组织中表达量为92.86%。随着分化程度的增加,ABBF1的表达量增加。
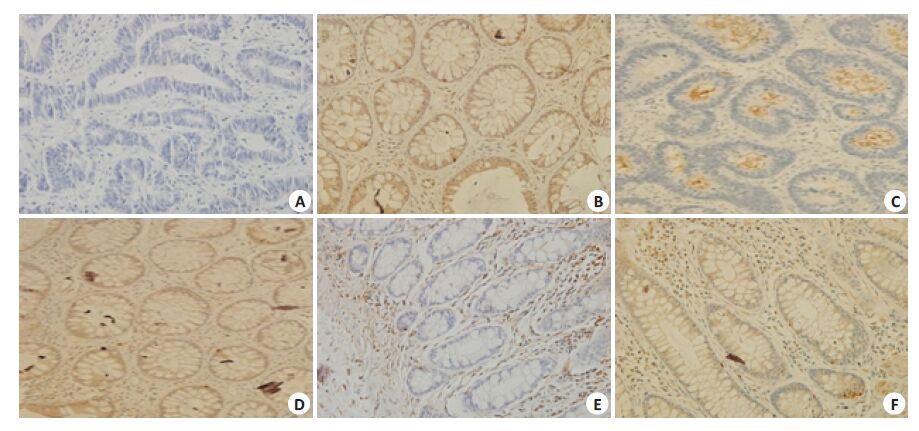
|
图1 不同分化程度癌组织及癌旁组织中ATBF1蛋白的表达 Fig.1 Expression of ATBF1 protein in poorly, moderately and well differentiated primary tumors and the adjacent tissues. A: Poorly differentiated primary tumor; B: Adjacent tissue of poorly differentiated tumor; C: Moderately differentiated primary tumor; D: Adjacent tissues of moderately differentiated tissue; E: Well differentiated primary tumor; F: Adjacent tissue of well differentiated tumor (SP, original magnification: ×200). |
ATBF1 蛋白在LOVO 细胞株、HCT116 细胞株、 LS174T细胞株、SW620细胞株、SW480细胞系中均有表达,但是各个细胞株中的表达量均不相同。实验结果表明转移性较强的LOVO 细胞株较转移性较弱的SW480而言,ATBF1表达量明显降低。不同的细胞株中胞浆和胞核中ABF1的表达存在明显差异,SW480细胞株核内ATBF1表达明显高于其他细胞株(图2)。
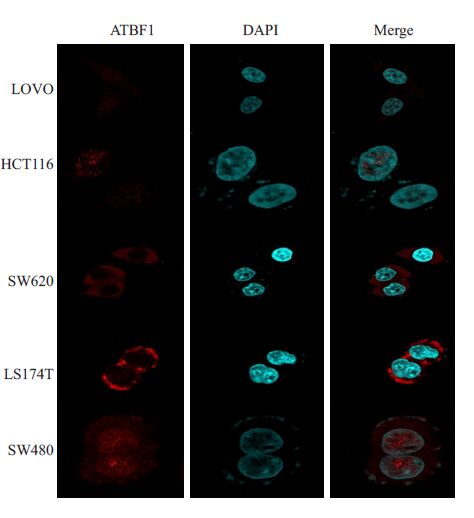
|
图2 ATBF1 蛋白在LOVO、HCT116、LS174T、SW620、 SW480细胞株中的表达 Fig.2 Expression of ATBF1-A protein in LOVO, HCT116, LS174T, SW620, and SW480 cell lines. |
ATBF1-A蛋白是ATBF1蛋白的主要表达形式,其能抑制癌细胞生长。如图3所示癌旁组织和癌组织中的ATBF1-A 蛋白的表达量存在着差异,癌旁组织中ATBF1-A蛋白的表达量高于癌组织,随着分化程度的增加,ABBF1-A的表达量增加。
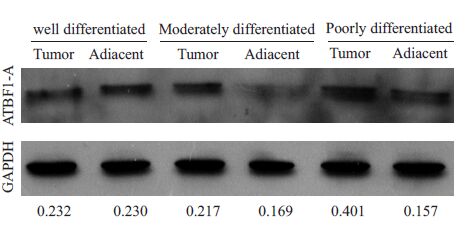
|
图3 ATBF1-A蛋白在不同分化的癌组织及癌旁组织中的表达 Fig.3 Expression of ATBF1 protein in poorly, moderately and well differentiated primary tumors and the adjacent tissues of colorectal cancer. |
通过免疫印迹检测可知,ATBF1-A 蛋白在sw480 细胞株中的表达量最高,在LOVO细胞株中表达量最低,其他细胞株中表达量从高到低依次为:SW620细胞株、LS174T细胞株、HCT116细胞株。而这一检测结果与激光共聚焦的检测结果基本一致(图4)。
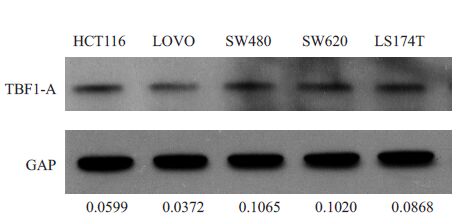
|
图4 ATBF1-A 蛋白在LOVO、HCT116、LS174T、 SW620、SW480细胞系表达 Fig.4 Expression of ATBF1-A protein in LOVO, HCT116, LS174T, SW620, and SW480 cell lines. |
运用Livak法变化形式用参照基因的ΔCT 法方法计算出目的基因的表达量。通过配对t 检验,t 值为1.689,表示结直肠癌癌组织中ATBF1mRNA的表达量与癌旁组织中的表达量无显著统计学意义(P>0.05)。在结直肠癌组织中ATBF1mRNA的表达量与ATBF1 蛋白的表达不具有一致性。此表的内容在正文中描述。
2.8 ATBF1mRNA在LOVO细胞株、HCT116 细胞株、 LS174T细胞株、SW620细胞株、SW480细胞系中的表达运用2-△△CT计算出每个细胞株中ATBF1 mRNA水平的相对与LOVO细胞株的表达量。结果发现转移性较强的LOVO细胞株较转移性较弱的SW480细胞株中ATBF1 mRNA表达含量要低。最高的是LS174T细胞株,而这一统计结果与ATBF1蛋白表达统计结果趋势不具有一致性。但是可以肯定的是转移性较强的LOVO细胞株较转移性较弱的SW480 细胞株中RNA 表达量明显要低(图5)。
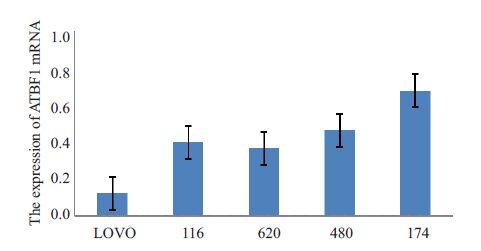
|
图5 LOVO、HCT116、LS174T、SW620、SW480胞株中ATBF1 mRNA表达 Fig.5 Expression of ATBF1 mRNA in LOVO, HCT116, LS174T, SW620, and SW480 cell lines. |
结直肠癌的发生、发展是一个极其复杂的过程,因此对结直肠癌的发病机制一直处于探索阶段。近年来在结直肠癌基因治疗研究过程中,已探寻了多个基因位点,但仍未寻找到特异性靶点。ATBF1为相对分子质量404 的转录因子,包含着4 个同源域和23 个锌指结构,在不同的器官中表现出不同的生物学效应,在多种癌症中ATBF1基因均在基因水平上发生改变[11],有研究表明在小肠绒毛的基底部和隐窝中有ATBF1的基因表达[12],同时ATBF1移码突变伴随着高度微卫星不稳定现象的发生会影响结直肠癌的发生[13],但是ATBF1 基因对结直肠癌发生发展却无系统性报道。
ATBF1与其他基因发生着相互作用,影响着其他基因的表达同时影响细胞的生长与凋亡[14, 15],例如Sun 等[16]研究发现ATBF1与PREN的缺失具有叠加效应从而影响前列腺癌的发生、发展,Sakata等[17]发现ATBF1 协同TGF-β信号通路对AFP启动子的表达进行抑制。 本研究发现在结直肠癌的癌组织及癌旁组织中均可检测到ATBF1 蛋白的表达,但结直肠癌的癌组织和癌旁组织中的表达量存在着差异性,因此通过对ATBF1 的研究可协助我们进一步探讨结直肠癌的发生、发展机制。
本研究发现ATBF1蛋白的表达与结直肠癌的分化程度及肿瘤的远处转移性有关,与肿瘤患者性别、肿瘤生长位置、淋巴结转移情况则无明显相关性。结直肠癌的分化程度越低,ATBF1蛋白的表达量越低,若结直肠癌患者发生了转移则ATBF1 蛋白的表达量会明显降低,与此同时,转移性较弱的SW480 细胞株中ATBF1 蛋白表达量明显高于转移性相对较强的LOVO细胞株, 从而进一步证实了ATBF1蛋白的表达与结直肠癌的转移性相关。因此我们认为ATBF1在结直肠癌的发生、 发展中仍起着抑癌基因作用。作为结直肠癌抑癌基因ATBF1可以作为基因治疗的新靶点,通过改变ATBF1 蛋白的表达从而影响结直肠癌的发生、发展,同时还可以用于对结直肠癌的筛查和预测结直肠癌患者预后的指标。
ATBF1已被证实为一个主要定位于细胞核上的转录因子[5, 11, 18],ATBF1蛋白由核内向胞浆转移可能与患者预后相关[11, 12, 19, 20]。但Sun等[11]研究发现在转移性鳞状上皮细胞肿瘤中核内ATBF1 的表达量明显减少,而胞质中ATBF1 水平却显著升高,这种现象在原位癌与浸润癌的比较中尤为明显,而这种细胞核中ATBF1 蛋白向胞质中转移的现象与极差的预后率密切相关。转移性的强弱与肿瘤的预后密切相关,在本研究中,转移性较强的LOVO 细胞株较转移性较弱的SW480 细胞株,细胞核中ATBF1 蛋白向胞质中转移的现象亚欧明显,这也意味着胞浆和胞核中ATBF1 蛋白的重新分布与患者预后在也可能存在着某种相关性。而这一现象却可作为我们判断结直肠癌预后的一个参考指标。
ATBF1mRNA的表达水平与ATBF1 蛋白的表达水平不具有显著相关性。通过RT-PCR对中分化结直肠癌患者的癌组织及癌旁组织中mRNA检测结果显示癌组织与癌旁组织中mRNA的表达并无显著差异性, 研究结果表明ATBF1mRNA的表达水平与ATBF1 蛋白的表达水平不具有显著相关性。这一结论在对结直肠癌细胞系的检测中也得到了相应结论。在mRNA水平上转移性较弱的SW480 细胞株ATBF1mRNA的表达水平明显要高于转移性较强的LOVO细胞株。但是与ATBF1 蛋白的表达水平相比较,在其他细胞株中ATBF1mRNA的表达水平与ATBF1蛋白的表达并不具有一致性,这也说明ATBF1蛋白的表达水平与ATBF1 mRNA的表达水平无明显相关性。Zhang等[19]在乳腺癌转移患者研究了ATBF1-A 蛋白的表达及ATBF1-A mRNA表达水平实验也得到了相同结论。我们假设ATBF1蛋白的翻译过程中发生了某种改变,但具体机制却不明确,则需进一步探讨。
鉴于上述结果,我们认为,ATBF1在结直肠癌中作为抑癌基因呈现,参与了结直肠癌的发生和发展,与结直肠癌的分化及转移密切相关,对ATBF1蛋白的检测可有助于预测结直肠癌的分化程度及转移情况,这为结直肠癌的基因治疗提供了新的靶点和思路。然而, ATBF1在结直肠癌的发生、发展过程中具体的作用机制还有待于我们进一步去研究证实。
| [1] |
中华人民共和国卫生和计划生育委员会医政医管局, 中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2015版)[J]. 中华消化外科杂志, 2015, 14(10): 783-99. ( 1) 1)
|
| [2] |
Miura Y, Tam T, Ido A, et al. Cloning and characterization of an ATBF1 isoform that expresses in a neuronal differentiationdependent manner[J]. J Biol Chem, 1995, 270(45): 26840-8. ( 1) 1)
|
| [3] |
Sun X, Frierson HF, Chen C, et al. Frequent somatic mutations of the transcription factor ATBF1 in human prostate cancer[J]. Nat Genet, 2005, 37(4): 407-12. ( 1) 1)
|
| [4] |
Sun X, Li J, Dong FN, et al. Characterization of nuclear localization and SUMOylation of the ATBF1 transcription factor in epithelial cells[J]. PLoS One, 2014, 9(3): e92746. ( 1) 1)
|
| [5] |
Li M, Fu X, Ma G, et al. Atbf1 regulates pubertal mammary gland development likely by inhibiting the pro-proliferative function of estrogen-ER signaling[J]. PLoS One, 2012, 7(12): e51283. ( 2) 2)
|
| [6] |
Jung CG, Uhm KO, Miura Y, et al. Beta-amyloid increases the expression level of ATBF1 responsible for death in cultured cortical neurons[J]. Mol Neurodegener, 2011, 6: 47. ( 1) 1)
|
| [7] |
Kim TS, Kawaguchi M, Suzuki M, et al. The ZFHX3 (ATBF1) transcription factor induces PDGFRB, which activates ATM in the cytoplasm to protect cerebellar neurons from oxidative stress[J]. Dis Model Mech, 2010, 3(11/12): 752-62. ( 1) 1)
|
| [8] |
Helenius IT, Haake RJ, Kwon YJ, et al. Identification of drosophila Zfh2 as a mediator of hypercapnic immune regulation by a Genome-Wide RNA interference screen[J]. J Immunol, 2016, 196 (2): 655-67. ( 1) 1)
|
| [9] |
Nojiri S, Joh T, Miura Y, et al. ATBF1 enhances the suppression of STAT3 signaling by interaction with PIAS3[J]. Biochem Biophys Res Commun, 2004, 314(1): 97-103. ( 1) 1)
|
| [10] |
Grasso CS, Wu YM, Robinson DR, et al. The mutational landscape of lethal castration-resistant prostate cancer[J]. Nature, 2012, 487 (746): 239-43. ( 1) 1)
|
| [11] |
Sun X, Li J, Sica G, et al. Interruption of nuclear localization of ATBF1 during the histopathologic progression of head and neck squamous cell carcinoma[J]. Head Neck, 2013, 35(7): 1007-14. ( 3) 3)
|
| [12] |
Mabuchi M, Kataoka H, Miura Y, et al. Tumor suppressor, AT motif binding factor 1 (ATBF1), translocates to the nucleus with runt domain transcription factor 3 (RUNX3) in response to TGF-beta signal transduction[J]. Biochem Biophys Res Commun, 2010, 398 (2): 321-5. ( 2) 2)
|
| [13] |
An CH, Kim SS, Kang MR, et al. Frameshift mutations of ATBF1, WNT9A, CYLD and PARK2 in gastric and colorectal carcinomas with high microsatellite instability[J]. Pathology, 2010, 42(6): 583-5. ( 1) 1)
|
| [14] |
Dong XY, Sun X, Guo P, et al. ATBF1 inhibits estrogen receptor (ER) function by selectively competing with AIB1 for binding to the ER in ER-positive breast cancer cells[J]. J Biol Chem, 2010, 285 (43): 32801-9. ( 1) 1)
|
| [15] |
Kaspar P, Dvoráková M, Králová J, et al. Myb-interacting protein, ATBF1, represses transcriptional activity of Myb oncoprotein[J]. J Biol Chem, 1999, 274(20): 14422-8. ( 1) 1)
|
| [16] |
Sun X, Xing C, Fu X, et al. Additive effect of Zfhx3/Atbf1 and Pten deletion on mouse prostatic tumorigenesis[J]. J Genetics Genomics, 2015, 42(7): 373-82. ( 1) 1)
|
| [17] |
Sakata N, Kaneko S, Ikeno S, et al. TGF-β signaling cooperates with AT Motif-Binding factor-1 for repression of the α -Fetoprotein promoter[J]. J Signal Transduct, 2014: 970346. ( 1) 1)
|
| [18] |
Li M, Zhao D, Ma G, et al. Upregulation of ATBF1 by progesterone-PR signaling and its functional implication in mammary epithelial cells[J]. Biochem Biophys Res Commun, 2013, 430(1): 358-63. ( 1) 1)
|
| [19] |
Zhang Z, Yamashita H, Toyama T, et al. ATBF1-a messenger RNA expression is correlated with better prognosis in breast cancer[J]. Clin Cancer Res, 2005, 11(1): 193-8. ( 2) 2)
|
| [20] |
Mori Y, Kataoka H, Miura Y, et al. Subcellular localization of ATBF1 regulates MUC5AC transcription in gastric cancer[J]. Int J Cancer, 2007, 121(2): 241-7. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
