硫酸钙人工骨作为一种骨移植替代材料在骨科的使用已有百年历史。它在临床上广泛应用于四肢、椎体及骨肿瘤刮除术后骨缺损的填充,以及作为抗生素、抗肿瘤药物等的载体。它具有良好的生物相容性、可降解吸收、骨传导性等宝贵特性[1, 2, 3, 4]。但是,在促进骨再生方面,硫酸钙的作用主要是骨传导性即为成骨细胞的长入提供支架,而不具有骨诱导性或成骨特性[4, 5]。理想的骨移植替代材料应该兼具骨传导性、骨诱导性以及良好的生物学特性。硫酸钙展现出了其中大部分宝贵特性。 在体外细胞培养实验中,成骨细胞可以贴附材料并且增殖旺盛,破骨细胞可以吞噬材料[6]。在体内动物实验中, 骨缺损处填充硫酸钙后,新骨自缺损两端长入,随着时间的延长,逐渐汇于中央部位,提示硫酸钙起骨传导作用[7]。如何使硫酸钙在保留原有特性的同时又具有骨诱导性是近年来的研究热点。
在自然界中,半水硫酸钙存在两种形式: α-CaSO4·½H2O与β-CaSO4·½H2O ,但前者的水化物机械强度更大,更适合临床应用。锶与钙同属碱土族元素,二者在人体中的含量超过99%集中在骨中。锶元素是人体中的必需微量元素,在骨的代谢中即能促进骨生成又能抑制骨的吸收[8]。它的作用机制在于增加成骨细胞相关基因的表达以及骨髓间充质干细胞(bonemesenchymal stem cells,BMSCs)中碱性磷酸酶的活性,同时抑制BMSCs 向破骨细胞分化所必需的NF-κB 受体活化因子[9, 10]。掺锶硫酸钙的制备早有报道,但是之前的研究为含锶化合物与硫酸钙的物理混合,无法保证产品在微观水平的均一性[11]。本研究的目的是将氢氧化锶、氢氧化钙等材料通过共沉淀、水热反应等化学方法,合成新型的含锶α-半水硫酸钙,以期使其同时拥有骨传导性及骨诱导性,满足临床使用要求。
1 材料和方法 1.1 材料分析纯氢氧化钙(Sigma)、分析纯氢氧化锶(Sigma)、 磁力搅拌器、高温压力反应釜;X 线衍射(D/Max- 2550pc,Rigaku Inc.)、傅里叶变换红外光谱(FTS-7, Bio-Rad,USA)、差式量热扫描(DIAMOND DSC,PE USA);培养箱(Quene systems-CWJ300DVBB)、倒置相差显微镜(OLYMPUS MIU-IBC-IF)、超净工作台(BSC-1300 IIA2)、酶标仪(Thermo MULTISKAN MK3 型)、离心机(ZONKIA SC-3610)、0.25%胰蛋白酶(Hyclone)、10%胎牛血清(Hyclone)、DMEM 培养基(Hyclone)、甲基四唑蓝(MTT,Sigma)、L-929小鼠成纤维细胞(江苏康众康民生物医药技术有限公司);清洁级新西兰大白兔,体质量2.0~2.5 kg;清洁级SD大鼠,体质量180~200 g(南方医科大学动物实验中心提供,许可证号:SCXK粤2011-0015)。
1.2 材料制备(1)共沉淀法制备含锶的二水硫酸钙:将含有氢氧化钙和氢氧化锶的化合物按9∶1的摩尔比进行混合,加入去离子水制成水溶液,然后将含混合液的烧杯放置于磁力搅拌器上,再将稀硫酸加入前述混合液中,滴入过程中保持30 ℃加热、持续搅拌,滴入完毕后维持加热及搅拌3 h。生成的沉淀经过滤、洗涤及干燥后,制成一定比例的含锶二水硫酸钙(步骤1)。方程式如下:
Ca(OH)2+H2SO4=CaSO4↓+2H2O
Sr(OH)2+H2SO4=SrSO4↓+2H2O
(2)水热法制备含锶的α-半水硫酸钙:将步骤1生成的产物按一定液固比与去离子水进行混合,利用水热反应釜在一定温度下反应6 h,后趁热将沉淀进行过滤、洗涤、干燥及球磨,即制得含锶α-半水硫酸钙;(3)结果评价:制得粉末进行X线衍射、傅里叶变换红外光谱及差式量热扫描表征检测,证明所制备产物为含锶α-半水硫酸钙。
1.3 材料浸提液制备依据GB/T 16886.12-2005,选用极性浸提介质生理盐水,以液固比1∶3的比例将固相粉剂与生理盐水进行调和,在糊状期制成圆柱形,直径3 mm,高10 mm。 以钴60辐照灭菌(广州华大生物科技有限公司),后按标准规定比例0.2 g/mL与生理盐水混合、密封,静置于37 ℃恒温箱中,浸提72 h。在体外细胞毒性实验中同法取DMEM培养液(含10%胎牛血清),37 ℃下浸提24 h, 取上清液备用。
1.4 体外细胞毒性试验(MTT法测定细胞相对增值率)试验使用L929 系细胞株(标准推荐),配制1× 105/mL的L929细胞悬液接种于96孔培养板,每孔接种100 μL。置于培养箱(37 ℃,5% CO2)培养24 h,待细胞大部分贴壁后,弃原培养基,用PBS液洗涤2次。实验组分别为100 μL的100%、75%、50%、25%浸提液,阴性对照组为100 μL相应的对照液,阳性对照组为100 μL 的0.64%苯酚溶液,每组18个复孔。分别于培养24、48、 72 h后取各组6孔进行MTT实验。在各观察期,弃去原培养液,然后加入MTT溶液20 μL,37 ℃下继续孵育4 h 后终止培养,吸去上清液,每孔加入150 μL 二甲基亚砜(DMSO),振荡10 min,用酶标仪在490 nm波长下测定其光吸收值(A490),每孔测量3次,取其平均值作为其吸光值结果。计算细胞相对增殖率(RGR)=A/A0×100% (A为实验样品组吸光度,A0为阴性对照组吸光度)。结果评价:采用六级毒性分级法即RGR≥100%,为0级; 75%~99%,为Ⅰ级;50%~74%,为Ⅱ级;25%~49%,为Ⅲ 级;1%~25%,为Ⅳ级;0,为Ⅴ级。
1.5 溶血试验抽取兔静脉血10 mL,加入到含有抗凝剂的真空试管中。取8 mL抗凝兔血,加入10 mL生理盐水稀释。 实验分组设置为实验组、阴性对照组和阳性对照组,分别加入10 mL浸提液、10 mL生理盐水和10 mL蒸馏水,每组平行操作3管。37 ℃水浴箱中保温30 min,分别加入0.2 mL稀释抗凝兔血后,继续37 ℃保温60 min。 再将各管离心5 min,2000 r/min,每管取上清液测定各管在545 nm处的吸光度(A),取同组的3支试管的平均值。计算公式为:溶血率(%)=(实验组吸光度-阴性对照组吸光度)/(阳性对照组吸光度-阴性对照组吸光度)× 100%。结果评价:合格判定指标规定为溶血率小于5%。
1.6 肌肉内植入实验取清洁级SD大鼠9只,以30 mg/kg的3%戊巴比妥钠溶液腹腔注射麻醉,无菌条件下,在大鼠脊柱中线两侧约1 cm处各选1个植入点,分离肌肉形成肌腔隙,植入被试材料(高10 mm,直径3 mm圆柱体),每侧各植入1个,右侧植入实验组(含锶硫酸钙),左侧作为空白对照组(切开但不植入),术后连续3 d肌注庆大霉素预防感染。结果评价:观察动物的活动及进食情况,切口反应情况。术后1、4、12周分别处死3只大鼠取材,常规组织切片,苏木精-伊红(HE)染色光镜下观察。
1.7 统计分析本文数据以均数±标准差表示,采用SPSS13.0软件统计分析,多组间比较采用单因素方差分析,P<0.05认为差异具有统计学意义。
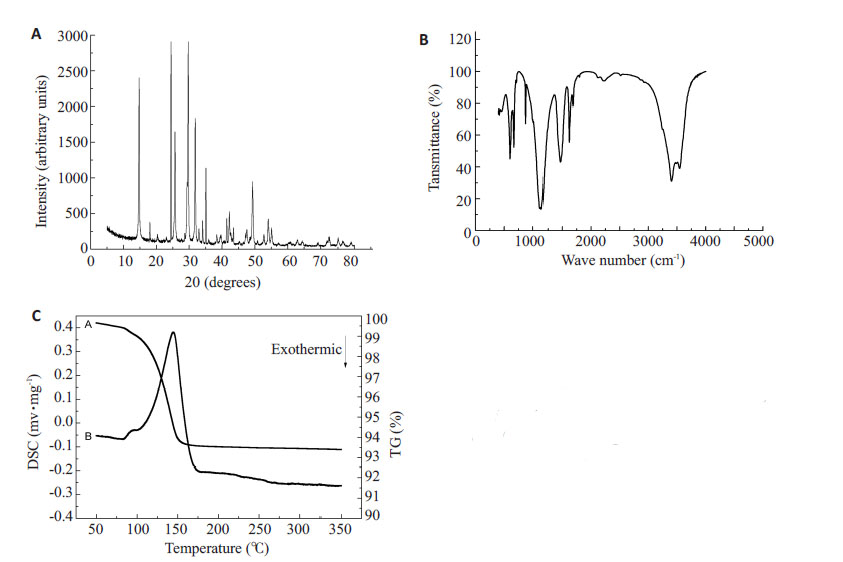
2 结果 2.1 制备所得材料表征结果X 线衍射结果(图1A)示:于14.63°,25.72°和29.80°处可见α-半水硫酸钙的特征3强峰;傅里叶变换红外光谱(图1B)与α-半水硫酸钙标准图谱相似,说明制备过程中锶元素的加入并未影响α-半水硫酸钙特有的性质。差式量热扫描结果(图1C),制备材料中结构水含量为6.03%,于146.37 ℃处可见吸热峰,而放热峰位于174.64 ℃处。
|
图1 各方法制备材料检测 Fig.1 Tests of the material with X-ray diffraction (A), Fourier transform infrared spectra (B), and thermogravimetric differential scanning calorimetry (C). |
(1)细胞形态学:3 d后各实验组细胞及阴性对照组均贴壁生长良好,细胞形态较均一,呈梭形、多角形,折光性强,可见分裂相细胞,阳性对照组可见细胞体积减小呈固缩状态,部分细胞发生溶解(图2);(2)各实验组不同时间的细胞增殖率:随着时间的增加,各实验组A490 呈现增大的趋势,各实验组与阴性对照组A490值比较差异无统计学意义(P>0.05)。而不同时间点各实验组及阴性对照组的A490值与阳性对照组(苯酚)比较差异均有统计学意义(P<0.05,表1);(3)细胞毒性评价:实验组、 阴性对照组不同时间点的毒性反应均为Ⅰ级,无细胞毒性;而阳性对照组毒性反应均为Ⅳ级,有细胞毒性(表2)。

|
图2 各组3 d后细胞形态 Fig.2 Morphological change of the cells incubated for 3 days with different concentrations of the aqueous extract of the material (Original magnification: × 200). A: Negative control; B: Positive control; C-F: Cells incubated in the presence of 100%, 75%, 50%, and 25% of the extract, respectively. |
| 表1 6组不同时间点A490检测结果 Table 1 A490 values of the incubated for 1, 2, and 3 days with different concentrations of the aqueous extract of the material (Mean±SD) |
| 表2 5组不同时间RGR值以及细胞毒性分级 Table 2 RGR value and toxicity grading of the aqueous extract of the material at different concentrations |
实验组的溶血率为4.3%<5%,判定为合格即被试材料不会引起溶血反应(表3)。
| 表3 3组溶血试验结果 Table 3 Result of hemolysis test of 3 groups |
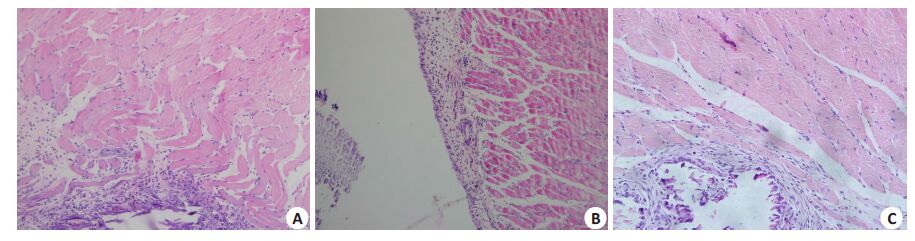
术后所有大鼠进食正常,活动自如,伤口无发红、渗出等炎性表现,愈合良好,无植入物排出现象,术后1周未见包膜形成,术后4、12周可见包膜组织。组织学观察,术后1周,光镜下见材料周围以淋巴细胞浸润为主的炎症反应,可见巨噬细胞,无明显纤维包裹形成。术后4周,材料周围可见少量淋巴细胞及多核巨细胞,有成纤维细胞增殖,纤维囊腔形成。术后12周,可见少量淋巴细胞,纤维包裹形成(图3)。空白对照组标本各期观察结构正常。
|
图3 组织HE染色结果 Fig.3 HE staining of the muscular tissue where the material was implanted (Original magnification: ×100). A-C: 1, 4, and 12 weeks after the implantation. |
掺锶硫酸钙的制备早有报道,但是之前的研究为含锶化合物与硫酸钙的物理混合,无法保证产品在微观水平的均一性[11]。通过化学合成方法来探讨锶与硫酸钙结合后的理化性质及其生物相容性还未有报道。本研究的目的是将氢氧化锶、氢氧化钙等材料通过共沉淀、 水热反应等化学方法,合成新型的含锶α-半水硫酸钙, 以期使其同时拥有骨传导性及骨诱导性,满足临床使用要求。
在前期材料制备过程中,我们将氢氧化锶、氢氧化钙等材料通过共沉淀、水热反应两个步骤制备出含锶硫酸钙粉末。我们采用X线衍射、傅里叶变换红外光谱以及差式量热扫描进行材料的鉴定。X线衍射结果示:于14.63°,25.72°和29.80°处可见α-半水硫酸钙的特征三强峰,而在24.78°处可见锶元素的特征峰[12];傅里叶变换红外光谱与α-半水硫酸钙标准图谱相似,说明制备过程中锶元素的加入并未影响α-半水硫酸钙特有的性质。差式量热扫描结果,制备材料中结构水含量为6.03%, 与单纯α-半水硫酸钙的6.20%相类似。如图所示,于146.37 ℃处可见吸热峰,而放热峰位于174.64 ℃处,进一步证实了制备材料具备α-半水硫酸钙的性质[13]。 通过以上方法鉴定,我们证明了所制备的材料为含锶α- 半水硫酸钙。
依据《医疗器械生物学评价》(GB/T 16886.1-2011), 我们选择了细胞毒性试验、溶血试验及体内植入试验对上述材料进行了初步的生物相容性评价。在细胞毒性试验中我们采用了MTT比色法[14]。这种方法的优点在于特异性强、灵敏度高、快速简便且重复性好以及操作简便,实验结果客观,可以精确反映细胞的增殖活性,间接反应受试材料的细胞毒性[15]。实验结果表明被试材料不同比例浸提液的毒性分级均为I级,且与阴性对照组相比没有统计学差异,没有显示出细胞毒性。被试材料在临床应用并非直接用于血管内注射,其组分更多是由其浸泡接触的组织液渗透回血液中,因此选用了溶血试验进行血液相容性评价。溶血验通过测定红细胞释放的血红蛋白量以判定被试材料的体外溶血程度。导致溶血的原因主要包括机械物理损伤和材料可溶性残余低分子化学作用两方面[16]。试验结果显示溶血率小于5%,未观察到明显溶血现象,符合溶血试验要求。体内植入试验主要用于评价植入物对活体组织的局部毒性反应,本试验结果显示术后1周材料周围形成炎性细胞浸润,一方面植入物可能刺激机体产生异物反应,另一方面可能与手术创伤刺激有关,术后4周可见纤维细胞增殖及异物巨细胞,炎性浸润减轻,表现为慢性炎症反应,术后12周仍可见少量炎性细胞,但与之前相比, 炎症反应无进展,同时形成纤维包膜,说明材料与组织达到稳定状态。
因此,本研究制备的含锶硫酸钙无细胞毒性,不引起溶血反应,体内植入对组织刺激小,具有良好的生物相容性,但其力学特性、降解率及骨传导性等尚需进一步试验研究。
| [1] |
Peltier LF. The use of plaster of Paris to fill large defects in bone: a preliminary report. 1959[J]. Clin Orthop Relat Res, 2001(382): 3-5. ( 1) 1)
|
| [2] |
Pandit N, Sharma A, Jain A, et al. The use of nanocrystalline and two other forms of Calcium sulfate in the treatment of infrabony defects: A clinical and radiographic study[J]. J Indian Soc Periodontol, 2015, 19(5): 545-53. ( 1) 1)
|
| [3] |
Morley R, Lopez F, Webb F. Calcium sulphate as a drug delivery system in a deep diabetic foot infection[J]. Foot (Edinb), 2015, pii: S0958-2592(15): 7. ( 1) 1)
|
| [4] |
Beuerlein MJ, Mckee MD. Calcium sulfates: what is the evidence?[J].J Orthop Trauma, 2010, 24(Suppl 1): S46-51. ( 1) 1)
|
| [5] |
Kanellakopoulou K, Galanopoulos I, Soranoglou V, et al. Treatment of experimental osteomyelitis caused by methicillin-resistant Staphylococcus aureus with a synthetic carrier of Calcium sulphate (Stimulan (R)) releasing moxifloxacin[J]. Int J Antimicrob Agents, 2009, 33(4): 354-9. ( 1) 1)
|
| [6] |
李伟, 黄强, 黄丹丹. 掺锶硫酸钙骨修复材料体外细胞相容性研究[J].成都医学院学报, 2013, 8(2): 152-5. ( 1) 1)
|
| [7] |
张春丽, 赵彦涛, 侯树勋, 等. 新型掺锶硫酸钙材料的成骨细胞生长活性研究[J]. 中国骨伤, 2014, 27(5): 415-8. ( 1) 1)
|
| [8] |
Guan BH, Fu HL, Yu J, et al. Direct transformation of Calcium sulfite to α-calcium sulfate hemihydrate in a concentrated Ca-Mg- Mn chloride solution under atmospheric pressure[J]. Fuel, 2011, 90 (1): 36-41. ( 1) 1)
|
| [9] |
Guan BH, Yang L, Fu HL, et al. α-calcium sulfate hemihydrate preparation from FGD gypsum in recycling mixed salt solutions[J]. Chem Engin J, 2011, 174(1): 296-303. ( 1) 1)
|
| [10] |
Marie PJ, Felsenberg D, Brandi ML. How Strontium ranelate, via opposite effects on bone resorption and formation, prevents osteoporosis[J]. Osteoporos Int, 2011, 22(6): 1659-67. ( 1) 1)
|
| [11] |
Sidqui M, Collin P, Vitte C, et al. Osteoblast adherence and resorption activity of isolated osteoclasts on Calcium sulphate hemihydrate[J]. Biomaterials, 1995, 16(17): 1327-32. ( 2 2
|
| [12] |
Meunier PJ, Roux C, Seeman E, et al. The effects of Strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis[J]. N Engl J Med, 2004, 350(5): 459-68. ( 1) 1)
|
| [13] |
Peng S, Zhou G, Luk KD, et al. Strontium promotes osteogenic differentiation of mesenchymal stem cells through the Ras/MAPK signaling pathway[J]. Cell Physiol Biochem, 2009, 23(1/3): 165-74. ( 1) 1)
|
| [14] |
Fan X, Ren H, Luo X, et al. Mechanics, degradability, bioactivity, in vitro, and in vivo biocompatibility evaluation of poly(amino acid)/ hydroxyapatite/Calcium sulfate composite for potential loadbearing bone repair[J]. J Biomater Appl, 2016, 30(8): 1261-72. ( 1) 1)
|
| [15] |
Sylvester PW. Optimization of the tetrazolium dye (MTT) colorimetric assay for cellular growth and viability[J]. Methods Mol Biol, 2011, 716: 157-68. ( 1) 1)
|
| [16] |
刘文伟, 王弢, 战德松. 溶血试验检测碳化硅种植材料的生物相容性[J].中国组织工程研究与临床康复, 2008, 12(10): 1873-5. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
