南方医科大学南方医院2妇产科,广东 广州 510515
2Department of Obstetrics and Gynecology, Department of Obstetrics and Gynecology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
巨噬细胞是具有十分活跃生物学功能的一组异质细胞群,能表达多种受体,产生多种生物活性因子,在机体防御和免疫应答中发挥重要作用,也是炎症反应中的主要调控细胞[1]。巨噬细胞起源于血液单核细胞,其在机体各系统和组织器官中均广泛存在,在受到不同的刺激分化因子作用后,会分化为不同的亚型,发挥不同的生物学效应[1]。血管内皮细胞生长因子(VEGF)又叫血管通透性因子(VPF),是一种高度特异性地作用于血管内皮细胞的多功能因子[2, 3]。可以促进血管内皮细胞分裂、增殖以及诱导血管生成,是机体内促进血管生成的关键细胞因子之一[2]。既往研究显示,巨噬细胞是机体合成VEGF的重要来源,巨噬细胞通过分泌VEGF参与了多种病理生理过程,包括肿瘤的生长转移,子宫内膜血管生成微环境的建立等[4, 5]。前列腺素E(2 PGE2)是一种重要的生物活性物质,广泛存在于全身各种器官组织中,发挥多种生物功能和效应[6, 7]。研究显示,PGE2可以参与血管生成的调控,但是PGE2是否参与调控巨噬细胞分泌VEGF从而促进血管生成未见相关报道[8]。本研究采用不同浓度的PGE2 处理大鼠巨噬细胞株NR8383,探讨PGE2对NR8383合成VEGF,调控人脐静脉血管内皮细胞(HUVEC)迁移和成管的能力。
1 材料和方法 1.1 材料 1.1.1 细胞株及细胞培养大鼠巨噬细胞株NR8383 购自广州吉妮欧生物科技有限公司。大鼠巨噬细胞NR8383 复苏后常规培养,于含10%胎牛血清的RPMI 1640 培养液中培养于5% CO2 恒温孵育箱中37 ℃下培养传代。
1.1.2 药物与试剂RMPI 1640 培养基/胎牛血清/胰蛋白酶/双抗/Ⅱ型胶原酶均购自Sigma;兔抗大鼠VEGF 多克隆抗体(英国Abcam);Transwell 小室(美国Corning);Matrigel 基质胶(美国BD)EP2 受体拮抗剂AH6809/EP4 受体拮抗剂AH23848(美国CAYMAN, 货号:14050/19023);Trizol试剂(Invitrogen)。
1.2 方法 1.2.1 荧光定量PCR按照实际说明完成RNA 的抽提纯化和cDNA 的合成。反应条件:95 ℃ 3 min;60 ℃ 30 s,40个循环(95 ℃ 5 s;60 ℃ 30 s;)。重复3次。目的片段:R-VEGF-100 bp;内参片段:R-GAPDH-110 bp。 R-VEGF 上游引物:5'-TGTACCTCCACCATGCCAA GT-3',下游引物:5'-CTGCGCTGGTAGACGTCCA T-3';R-GAPDH:上游引物:5'-AGGGCTGCCTTCTC TTGTGA-3';下游引物:5'-AACTTGCCGTGGGTAG AGTCA-3'。
1.2.2 Western blot检测NR8383细胞中VEGF表达细胞按照比例加入裂解液,提取全蛋白,按照BCA方法测定蛋白浓度,分装并且保存在-80 ℃。根据目的蛋白分子量配置SDS-PAGE分离胶,蛋白上样后电泳,转膜, 4 ℃封闭过夜,免疫印迹,利用ECL显色试剂盒显色,在显影仪器上拍照,用Gel-pro analyzer图像分析软件分析条带灰度值,用目的蛋白灰度值/内参灰度值代表目的蛋白的相对表达量。
1.2.3 TRANSWELL细胞迁移实验(1)取对数生长期的大鼠巨噬细胞株NR8383,以含10%胎牛血清的RPMI 1640培养液重悬细胞,调整细胞密度为1×105/mL, 以不添加PGE2处理的NR8383 细胞作为对照组(以下简称NC组),其余分别采用0.1 nmol/L PGE2处理、 1 nmol/L PGE2 处理以及1 nmol/L PGE2 + 10 nmol/L AH6809 +10 nmol/LAH23848处理。5 d后,2000 r/min 离心5 min,去除细胞碎片,取细胞培养上清用于实验; (2)HUVEC细胞消化后用完全培养基重悬,调整细胞浓度为1×106/mL,Transwell 细胞培养板的上室中加入100 μL HUVECs 悬液;(3)在Transwell 细胞培养下室中,分别加入上述方法获取的不同处理作用后NR8383 细胞培养上清,每组设3个复孔。放入细胞培养箱中继续培养12 h;(4)取出Transwell小室,用棉棒轻轻擦去小室膜上表面的细胞;10%甲醛固定30 min;用PBS洗2 次,5 min/次;结晶紫染色30 min,清水反复冲洗,晾干; 取下聚碳酸酯膜,中性树胶封片;(5)显微镜下(×200)计数迁移到膜下表面的细胞,每张膜随机计数5个视野, 取平均数作为趋化细胞数。
1.2.4 Matrigel胶小管形成实验观察HUVEC细胞成管能力(1)在实验前预先将Tip头、培养板等所有实验中会接触Matrigel基质胶的物品放置在-20 ℃冰箱进行预冷。然后,把Matrigel基质胶置于2~8 ℃冰箱中过夜融化。当基质胶呈现液态状后,向96孔培养板中每孔加入60 μL,置于37 ℃ 1 h以成胶;(2)用上述方法(1.2.3) 获取的不同处理作用后NR3838 细胞培养上清重悬HUVECs,接种入已铺胶的96 孔板中,每孔1.5~2×104 个细胞,每组设3复孔。放入细胞培养箱中继续培养6 h; (3)取出细胞培养板,在倒置显微镜下(×4)观察并拍照, 采用Image-Pro Plus软件分析形成小管的面积。
1.3 统计学处理所有数据用SPSS20统计软件分析处理,两样本均数比较应用t检验,多样本均数比较应用方差分析。P< 0.05为差异具有统计学意义。
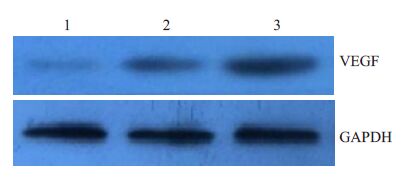
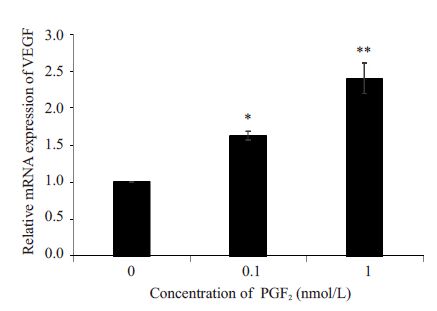
2 结果 2.1 PGE2对NR8383细胞合成VEGF的影响。采用Western blotting 分别检测不添加PGE2处理的对照组以及添加0.1 nmol/L、1 nmol/L PGE2处理5 d 的NR8383细胞中VEGF蛋白的表达水平;采用qPCR 法,检测不添加PGE2处理的对照组以及添加0.1 nmol/L、 1 nmol/L PGE2 处理5 d 的NR8383 细胞中VEGF mRNAs的表达水平。结果显示,NR8383细胞内VEGF 蛋白水平随着PGE2处理浓度的升高而升高;VEGF mRNAs的表达水平也随着PGE2处理浓度的升高而升高(图1,2)。其中1 nmol/L PGE2处理的NR8383细胞中VEGF mRNAs表达水平最高(表1,P<0.01)。表明NR8383 细胞中VEGF mRNAs的表达水平与PGE2水平呈剂量相关关系(图2)。
|
图1 不同浓度PGE2处理对NR8383 细胞内VEGF蛋白表达的影响 Fig.1 VEGF protein expression in NR8383 cells treated with different concentrations of PGE2. Lane 1: Negative control group; Lane 2: 0.1 nmol/L PGE2; Lane 3: 1 nmol/L PGE2. |
|
图2 不同浓度PGE2处理对NR8383细胞VEGF mRNAs 表达的影响 Fig.2 VEGF mRNAs expression in NR8383 cells treated with different concentrations of PGE2. *P<0.05, **P<0.05 vs NC group. |
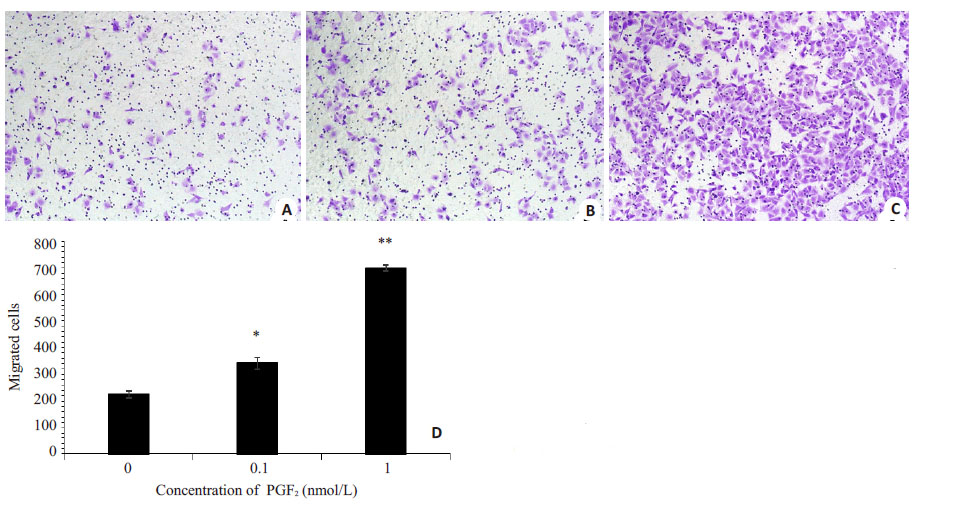
图3在显微镜下观察,分别应用不添加处理的对照组以及添加0.1 nmol/L、1 nmol/L PGE2处理大鼠巨噬细胞NR8383 5 d后收集的细胞上清液,分别处理HUVECs, 进行Transwell小室迁移实验。研究发现Transwell小室下表面的HUVECs数量随着PGE2处理浓度的升高而显著升高(图2),其中1 nmol/L PGE2处理后的NR8383细胞培养上清液对HUVECs的趋化作用最强(P<0.01)。
|
图3 不同浓度PGE2处理下NR8383细胞培养上清液对HUVECs迁移能力的影响 Fig.3 Migration ability of HUVECs treated with supernatants derived from NR8383 cells stimulated by different concentrations of PGE2. A: NC group (Original magnification: ×200); B: 0.1 nmol/L PGE2 group (×200); C: 1 nmol/L PGE2 group (× 200); D: Average number of HUVECs migrating across Transwell filter. *P<0.01, **P< 0.01 vs NC group. |
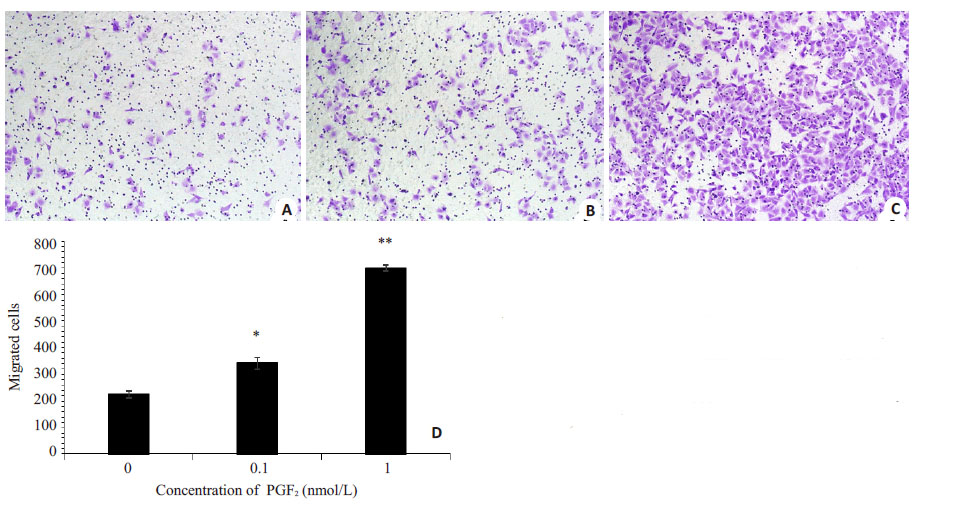
显微镜下观察,采用不添加处理的对照组以及添加0.1 nmol/L、1 nmol/L PGE2处理NR8383 细胞5 d 后分别取不同处理下的NR8383细胞培养上清液,诱导接种在Matrigel胶上的HUVECs逐渐形成管状结构。实验结果显示,HUVECs形成的管状结构面积随着PGE2浓度的升高而升高(图4),1 nmol/L PGE2 处理后的NR8383细胞上清液促进HUVECs成管的能力最强,结果具有统计学差异。
|
图4 不同浓度PGE2 处理下NR8383 细胞培养上清液对HUVECs成管能力的影响 Fig.4 Tube formation ability of HUVECs treated with supernatants derived from NR8383 cells stimulated by different concentrations of PGE2. A: NC group (Original magnification: ×4); B: 0.1 nmol/L PGE2 group (×4); C: 1 nmol/L PGE2 group (× 4); D: Formation of network-like structures by HUVECs. *P<0.01, **P<0.01 vs NC group. |
对1 nmol/L PGE2 处理的NR8383 细胞中加入10 nmol/L PGE2 EP2受体抑制剂AH6809和10 nmol/L EP4受体抑制剂AH23848,培养5 d后,取细胞上清液处理HUVECs。采用Transwell 细胞迁移实验发现AH6809+AH23848 可以显著抑制NR8383 细胞促进HUVECs迁移(图5A),采用Matrigel 胶细胞成管实验发现AH6809+AH23848可以显著抑制NR8383细胞促进HUVECs 成管的能力(图5B)。qPCR 实验发现AH6809+AH23848 可以显著抑制PGE2促进NR8383 细胞合成VEGF mRNAs的能力,数据具有显著统计学差异(图5C,P<0.01)。
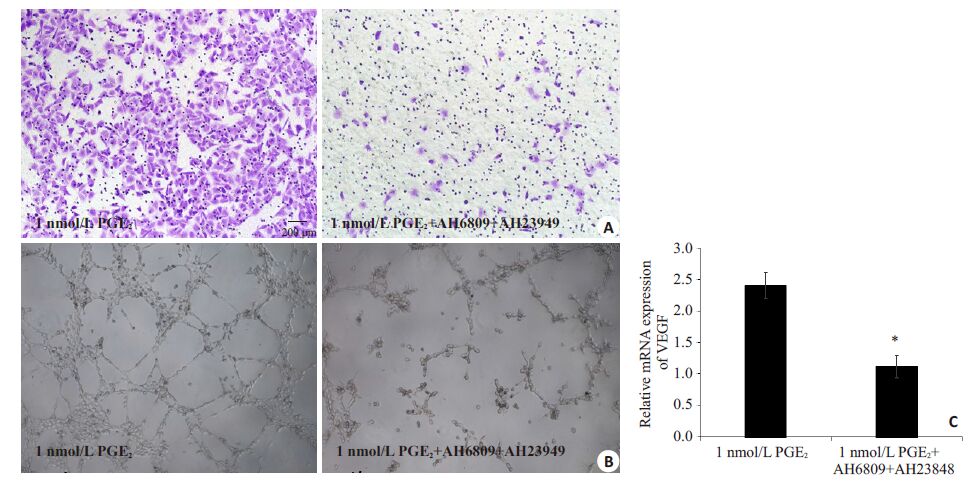
|
图5 PGE2 EP2受体拮抗剂AH6809和EP4受体拮抗剂AH23848显著抑制NR8383 细胞VEGF mRNAs的表达以及促进HUVECs趋化和成管的能力 Fig.5 AH6809 combined with AH23848 inhibits VEGF mRNA expression in NR8383 and blocks tube formation and migration of HUVECs. A: Average number of migrating HUVECs. AH6809 and AH23848 was used as antagonists for PGE2 (Original magnification: × 200); B: Formation of network-like structures by HUVECs treated with the conditioned supernatants (×4); C: Expression of VEGF mRNAs in cells treated with PGE2 alone or in combination with AH6809 and AH23848. *P<0.01 vs 1 nmol/L PGE2 group. |
巨噬细胞作为体内一种重要的非特异性免疫细胞, 在血管生成中的作用越来越受到学者的关注[9]。激活后的巨噬细胞可以释放VEGF,是体内VEGF的重要来源之一[1, 5, 10]。VEGF是已知诱导血管生成最主要的细胞因子之一,密切参与了体内多种病理生理性的血管生成活动[2]。PGE2是体内重要的生理活性物质,广泛存在于全身的组织器官中,发挥着多种生物活性效应,其中有研究发现,PGE2参与了体内VEGF的合成分泌,在血管生成活动中发挥着重要作用[6, 8, 11]。而巨噬细胞作为VEGF的重要来源,并且细胞膜表面也表达PGE2特异性受体EP2、EP4,是否提示PGE2可以作用于巨噬细胞表面对应的受体从而调控巨噬细胞合成分泌VEGF以及促进血管生成的能力呢[12]?
为了证实PGE2参与调控巨噬细胞促进血管新生的作用,我们采用大鼠巨噬细胞株NR8383和人脐静脉血管内皮细胞HUVECs进行体外细胞学实验。首先,我们体外培养大鼠巨噬细胞株NR8383 细胞,利用Western blot和荧光定量PCR方法,采用不添加处理以及添加0.1 nmol/L、1 nmol/L PGE2分别处理NR8383细胞,培养5 d后收集不同处理组的NR8383细胞,对其分别进行检测,观察其细胞内VEGF 蛋白和VEGF mRNAs的表达水平。研究结果显示,PGE2处理后的NR8383细胞内VEGF蛋白水平和VEGF mRNAs表达水平都显著升高,而且表达程度与处理浓度呈正相关。 初步提示,PGE2 可以促进NR8383 细胞合成更多的VEGF,来参与血管生成的活动。
为了进一步证实PGE2调控NR8383细胞促进血管生成的能力,我们利用Transwell 细胞迁移实验和Matrigel 胶细胞成管实验,来检测PGE2对NR8383 细胞调控HUVECs募集和成管作用。我们培养大鼠巨噬细胞株NR8383,不添加处理以及添加0.1 nmol/L、1 nmol/L PGE2处理的NR8383细胞,培养5 d后取细胞培养上清液。分别用不同处理下的NR8383细胞上清液作用于HUVECs,观察发生迁移的HUVECs 数量,检测HUVECs形成血管样结构的面积。研究发现,随着PGE2 处理浓度的升高,发生迁移的HUVECs数量明显升高; HUVECs形成的血管样结构面积也显著升高。这提示, PGE2可以增强NR8383细胞促进血管内皮细胞趋化和成管的能力,增强NR8383细胞促进血管生成的能力。
那么PGE2是否是通过作用于巨噬细胞表面其对应受体来影响NR8383细胞促进血管生成的能力呢?我们联合使用PGE2 特异性EP2、EP4 受体拮抗剂AH6809、AH23848处理NR8383细胞,观察发现其细胞培养上清液诱导迁移的HUVECs数量显著降低,并且形成的血管状结构面积显著减少;同时qPCR检测发现,使用PGE2 EP2和EP4受体拮抗剂处理后的NR8383 细胞内VEGF mRNAs的表达也受到明显抑制。这些结果均提示,PGE2通过作用NR8383细胞表面的EP2和EP4受体,调控NR8383细胞合成VEGF,影响其促进血管内皮细胞趋化和成管的能力。体外细胞学实验可以提示,PGE2是调控巨噬细胞合成VEGF的重要因子,影响其促进血管生成的能力。
围排卵期卵巢中会呈现一个巨噬细胞数量显著升高的现象,同时卵巢巨噬细胞在卵巢黄体血管网的形成过程中发挥着关键作用[13, 14];卵巢黄体血管网形成是合成分泌孕酮(P4)的组织学基础,而P4是子宫内膜容受性建立的关键[15, 16]。此外,我们的前期研究发现围着床期子宫内膜中巨噬细胞呈现一个募集的趋势,并且在着床点附近分布;其分布也与VEGF和子宫内膜容受性相关分子-白血病抑制因子(LIF)的表达密切相关[4, 17]。因此,PGE2可能是调控VEGF的合成,参与子宫内膜容受性建立以及胚胎着床的重要生物活性物质,值得进一步深入研究。
| [1] |
Glass CK, Natoli G. Molecular control of activation and priming in macrophages[J]. Nat Immunol, 2016, 17(1): 26-33. ( 3) 3)
|
| [2] |
Toi M, Matsumoto T, Bando H. Vascular endothelial growth factor: its prognostic, predictive, and therapeutic implications[J]. Lancet Oncol, 2001, 2(11): 667-73. ( 2) 2)
|
| [3] |
Eichmann A, Simons M. VEGF signaling inside vascular endothelial cells and beyond[J]. Curr Opin Cell Biol, 2012, 24(2): 188-93. ( 1) 1)
|
| [4] |
Tan W, Chen L, Guo L, et al. Relationship between macrophages in mouse uteri and angiogenesis in endometrium during the periimplantation period[J]. Theriogenology, 2014, 82(7): 1021-7. ( 2) 2)
|
| [5] |
Noy R, Pollard JW. Tumor-Associated macrophages: from mechanisms to therapy[J]. Immunity, 2014, 41(1): 49-61. ( 2) 2)
|
| [6] |
杨光锐, 管又飞. 前列腺素E2合酶的研究进展进展[J]. 生理学进展, 37 (2): 182-6. ( 2) 2)
|
| [7] |
Kim SO, Harris SM, Duffy DM. Prostaglandin E2 (EP) receptors mediate PGE2-specific events in ovulation and luteinization within primate ovarian follicles[J]. Endocrinology, 2014, 155(4): 1466-75. ( 1) 1)
|
| [8] |
Sakurai T, Tamura K, Kogo H. Stimulatory effects of eicosanoids on ovarian angiogenesis in early luteal phase in cyclooxygenase-2 inhibitor-treated rats[J]. Eur J Pharmacol, 2005, 516(2): 158-64. ( 2) 2)
|
| [9] |
Erlebacher A. Immunology of the maternal-fetal interface[J]. Annu Rev Immunol, 2013, 31(5): 387-411. ( 1) 1)
|
| [10] |
Murillo MM, Zelenay S, Nye E, et al. RAS interaction with PI3K p110α is required for tumor-induced angiogenesis[J]. J Clin Invest, 2014, 124(8): 3601-11. ( 1) 1)
|
| [11] |
Zhang YS, Daaka Y. PGE2 promotes angiogenesis through EP4 and PKAC gamma pathway[J]. Blood, 2011, 118(19): 5355-64. ( 1) 1)
|
| [12] |
Eruslanov E, Daurkin I, Ortiz J, et al. Pivotal advance: tumormediated induction of myeloid-derived suppressor cells and M2- polarized macrophages by altering intracellular PGE2 catabolism in myeloid cells[J]. J Leukoc Biol, 2010, 88(5): 839-48. ( 1) 1)
|
| [13] |
Mats BS. Localization of leukocyte subsets in the rat ovary during the periovulatory period[J]. Biol Reprod, 1993, 48(2): 277-86. ( 1) 1)
|
| [14] |
Care AS, Diener KR, Jasper MJ, et al. Macrophages regulate corpus luteum development during embryo implantation in mice[J]. J Clin Invest, 2013, 123(8): 3472-87. ( 1) 1)
|
| [15] |
Cha J, Sun X, Dey SK. Mechanisms of implantation: strategies for successful pregnancy[J]. Nat Med, 2012, 18(12): 1754-67. ( 1) 1)
|
| [16] |
Stocco C, Telleria C, Gibori G. The molecular control of corpus luteum formation, function, and regression[J]. Endocr Rev, 2007, 28 (1): 117-49. ( 1) 1)
|
| [17] |
高瑞花, 陈雷宁, 谭雯雅, 等. 围着床期小鼠子宫中巨噬细胞的变化及作用[J]. 南方医科大学学报, 2015(3): 365-9. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
