2 广东省人民医院//广东省医学科学院普外一区胃肠外科,广东 广州 510120
2 Department of Gastrointestinal Surgery, Guangdong General Hospital//Guangdong Academy of Medical Science, Guangzhou 510120, China
结直肠癌(CRC)是常见恶性肿瘤,发病率位居2015年我国恶性肿瘤发病男性的第5位和女性第4位,估计2015年CRC新发病人数为37.6万人,死亡人数达到19.1万人[1]。术后40%~50%患者出现术后复发或转移,其中绝大多数患者失去再治愈的机会;约20%病人在诊断时即处于转移阶段,其中位生存期低于2年[2],该类晚期或转移CRC 对化疗药物的反应仅有10%~20%,导致CRC 的远期预后很差[3]。
《医学入门》记载蟾酥:“主痈疽疔肿瘰疬,一切恶疮顽癣”;《本草纲目》:“治发背疔疮,一切恶肿”。我们此前的研究显示,蟾酥成分沙蟾毒精诱导结肠癌细胞发生凋亡,线粒体磷酸甘油酸变位酶5L(PGAM5L)与动力相关蛋白1 以及Bax 形成复合物对于内源性凋亡的执行是必需的[4]。远华蟾蜍精(TBG)是从中华大蟾蜍蟾酥中提取纯化的活性成分之一[5],但TBG对CRC的作用尚未见报道。本实验旨在分析TBG 对CRC 细胞活力的影响并对其可能的分子机制进行探讨。
1 材料和方法 1.1 细胞系及主要试剂人结肠腺瘤上皮细胞系SW480细胞、HCT 116购自美国模式培养物集存库,由南方医科大学中医药学院分子生物实验室保存;远华蟾蜍精购自宝鸡市辰光生物科技公司;细胞培养基RPMI 1640(Hyclone);胎牛血清(Gibco);四甲基偶氮唑盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]和二甲基亚砜(Dimethyl sulfoxide,DMSO)购自MP;DCFH-DA够自Sigma;Hoechst 33342 试剂盒(上海鼎国生物技术公司);AnnexinV-7AAD 细胞凋亡检测试剂盒(美国BD);JC-1 够自MCE 公司;p53、Bax、Caspase 9、聚腺苷二磷酸核糖聚合酶[Poly(ADPribose)polymerase,PARP]一抗、Stress and ApoptosisSignaling Antibody Array Kit购自美国CST。
1.2 MTT法检测细胞活力收集对数期细胞,调整细胞密度约1×105/孔。细胞贴壁后,分别加入浓度梯度的TBG(0、0.1、1.0、2.5、5、10 μmol/L),分别培养24、48 h后,每孔中加入5 mg/mLMTT 20 μL。酶联免疫检测仪A490 nm处测量吸光值。细胞生存率=处理组吸光度值/对照组吸光度值,实验重复3次。
1.3 流式细胞术检测细胞凋亡TBG处理细胞24 h,收集细胞,按照我们此前建立的方法,选用Annexin V-PE/7AAD双染试剂盒,操作按试剂盒操作指南进行[4],实验重复3次。
1.4 Hoechst 33342染色贴壁细胞弃培养基,用PBS清洗1~2次。每孔加入35 μL Hoechst 33342工作液,置于37 ℃温育15~20 min。弃去Hoechst 33342染液,PBS洗涤1~2次,用荧光显微镜拍照分析[4]。
1.5 ROS和线粒体膜电位分析应用DCFH-DA 和JC-1 分别检测细胞内ROS和线粒体膜电位。DCFH-DA孵育30 min,无血清培养液冲洗HCT116细胞3 次,15 min 内各孔荧光强度流式细胞仪检测,结果以与对照组ROS 含量的百分比表示。0.5 mL JC-1工作液染色后,加入250 μL 1×缓冲液,经FACSCalibur流式细胞仪检测,用Cel1Quest软件分析荧光相对强度,观察细胞线粒体膜电位的变化。
1.6 蛋白免疫印迹检测蛋白表达用BCA法蛋白定量后,每组取约30 μg蛋白样品,加入5倍上样缓冲液后上样至12% 聚丙烯酰胺凝胶进行电泳,湿转法转印至聚偏氟乙烯膜。5%脱脂奶粉室温封闭1 h。一抗4 ℃孵育过夜。辣根过氧化物酶偶联的相应二抗(1∶1000稀释)室温孵育1 h。最后用增强化学发光法显色、曝光。每组样品重复上样检测3次。目的条带用Image J 软件分析相对灰度值(以β-actin 为参照)[7]。
1.7 应激与凋亡信号抗体芯片检测相关蛋白变化TBG 处理24 h 后,应用全蛋白抽提试剂盒提取蛋白,蛋白用BCA法进行蛋白定量后,每组取约0.5~1 μg/μL浓度的蛋白样品加入组装好的对应黑色多孔隔离槽中过夜孵育。次日用试剂盒中的复合一抗室温震荡反应1 h,辣根过氧化物酶偶联的相应二抗室温震荡孵育0.5 h。最后配置混合后显影试剂用化学发光数字成像仪曝光。目的靶点用Image J软件分析相对灰度值(以阳性对照为参照)。
1.8 统计学处理采用SPSS20.0软件,数据以均数±标准差表示,采用单因素方差分析,若方差齐,组间多重比较采用LSD方法检验;若方差不齐多重比较采用Dunnett's T3,P<0.05被认为差异具有统计学意义。
2 结果 2.1 TBG抑制CRC细胞活力分别用0、0.1、1.0、2.5、5、10 μmol/L TBG 处理HCT116、SW480 和NCM460 3 种细胞24 h 和48 h,TBG 以浓度及时间依赖方式降低CRC 细胞活力HCT116 和SW480 的细胞活力,到5 μmol/L细胞增殖抑制率达到平台水平(图1A,B)。TBG对人正常肠上皮细胞NCM460的杀伤作用较结肠癌细胞减弱(图1C)。HCT116细胞的24 h IC50值为3.93 μmol/L,SW480细胞的24 h IC50值为5.10 μmol/L,NCM460细胞的24 h IC50值为34.7 μmol/L,表明TBG对CRC肿瘤细胞有更强杀伤作用。
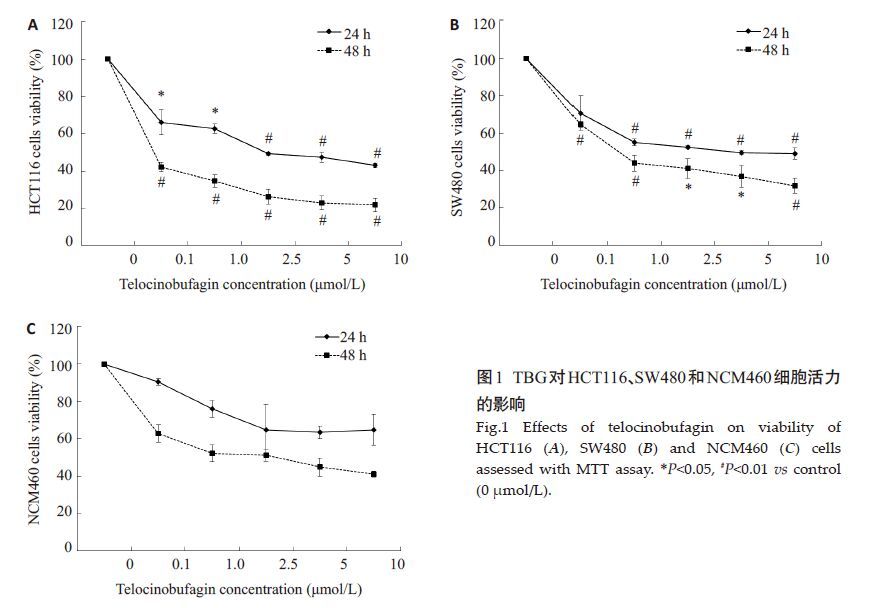
|
图1 TBG对HCT116、SW480和NCM460细胞活力的影响 Fig.1 Effects of telocinobufagin on viability of HCT116 (A), SW480 (B) and NCM460 (C) cells assessed with MTT assay. *P<0.05, #P<0.01 vs control (0 μmol/L). |
Annexin V-PE/7AAD双染的流式细胞分析结果显示(图2A),随着TBG浓度的增加,HCT116的细胞凋亡率逐步上升。0.1、1.0、2.5 μmol/L TBG引起的AnnexinV阳性细胞比例分别是(7.63±0.33)%、(9.33±0.76)%、(12.24±0.91)%(图2C),表明TBG显著增加HCT116细胞凋亡率。
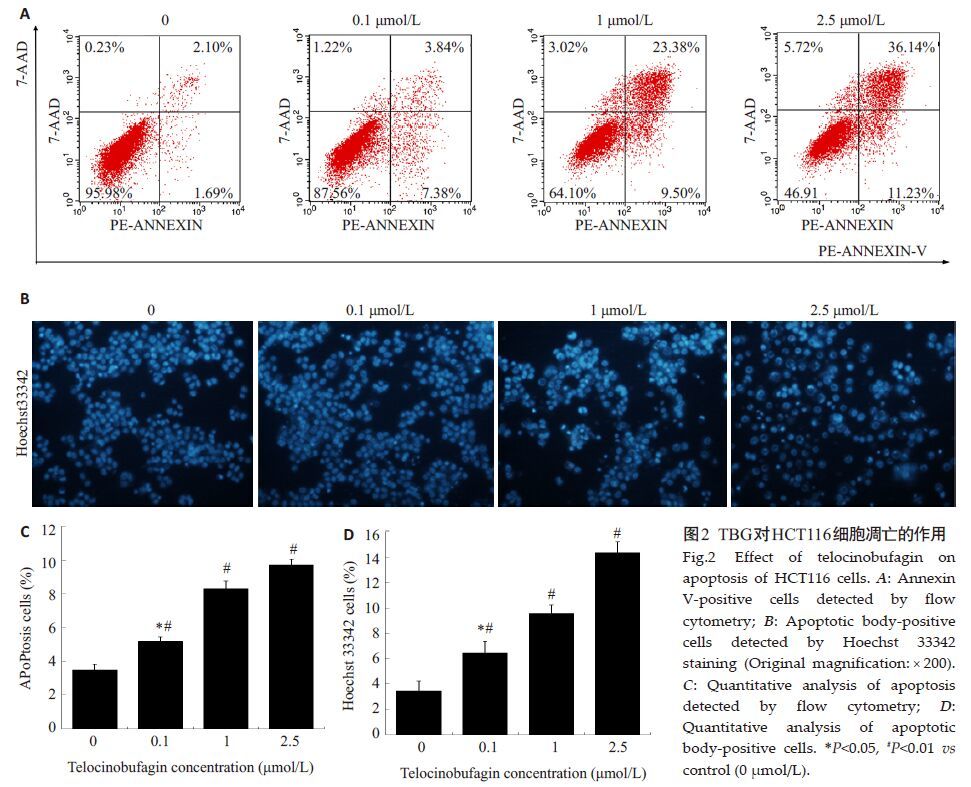
|
图2 TBG对HCT116细胞凋亡的作用 Fig.2 Effect of telocinobufagin on apoptosis of HCT116 cells. A: Annexin V-positive cells detected by flow cytometry; B: Apoptotic body-positive cells detected by Hoechst 33342 staining (Original magnification: × 200). C: Quantitative analysis of apoptosis detected by flow cytometry; D: Quantitative analysis of apoptotic body-positive cells. *P<0.05, #P<0.01 vs control (0 μmol/L). |
Hoechst 33342染色显示,TBG诱导细胞出现染色质凝集,发生核固缩,形成大量典型的凋亡小体(图2B),0.1、1.0、2.5 μmol/L引起细胞凋亡的比例分别是(6.43 ± 0.93)%、(9.57 ± 0.68)%、(14.37 ± 0.85)%(图2D)。结合流式细胞仪分析结果,表明TBG能以剂量依赖的方式促进CRC细胞发生凋亡。
2.3 TBG诱导CRC细胞内ROS增加和线粒体膜电位降低TBG处理24 h,应用荧光探针CM-H2DCFDA观察细胞内ROS,TBG 显著增加细胞内ROS 水平(图3A);应用JC-1染色监测线粒体膜电位,发现TBG以剂量依赖的方式显著降低CRC细胞线粒体膜电位(图3B)。
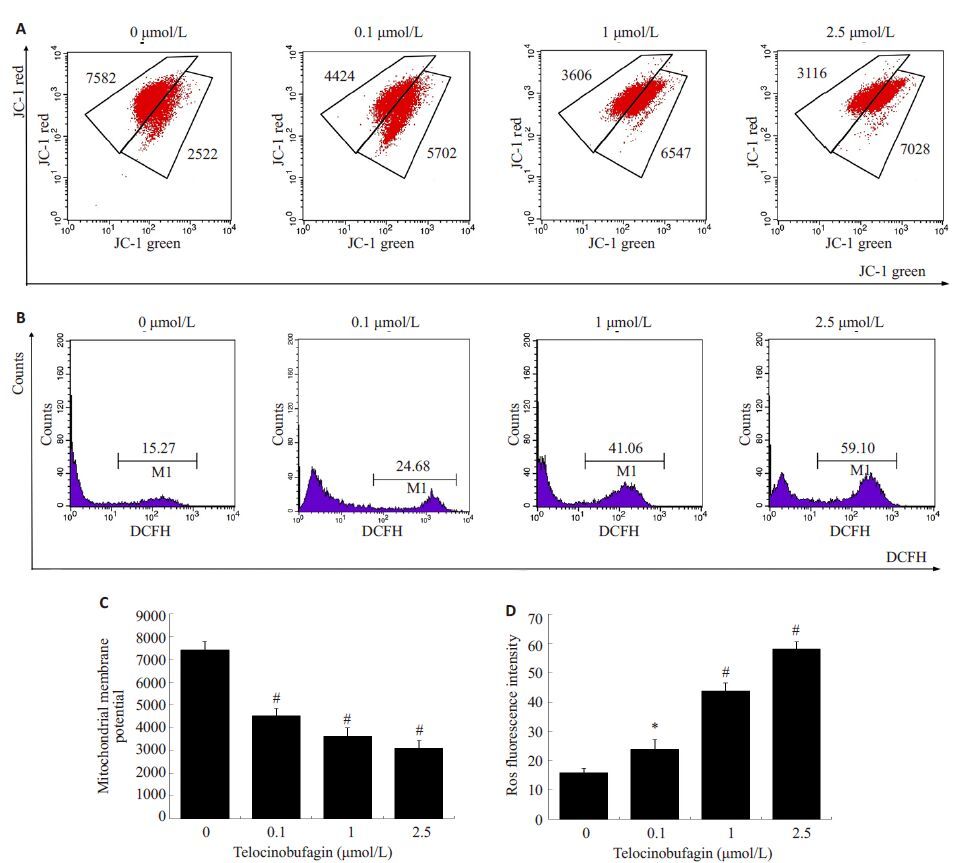
|
图3 TBG对CRC细胞线粒体膜电位和ROS水平变化的作用 Fig.3 Effects of telocinobufagin on mitochondrial membrane potential and ROS in CRC cells. A: Mitochondrial membrane potential; B: ROS levels; C: Quantitative analysis of mitochondrial membrane potential; D: Quantitative analysis of ROS. *P<0.05, #P<0.01 vs control (0 μmol/L). |
应用蛋白免疫印迹检查凋亡相关蛋白表达,结果显示TBG引起HCT116 细胞中p53、Bax 表达显著升高,caspase 9和PARP蛋白出现片段化(图4A)。上述结果说明TBG 诱导p53 和Bax 的活化,导致Caspase 9 和PARP发生剪切进而激活凋亡通路(图4B)。
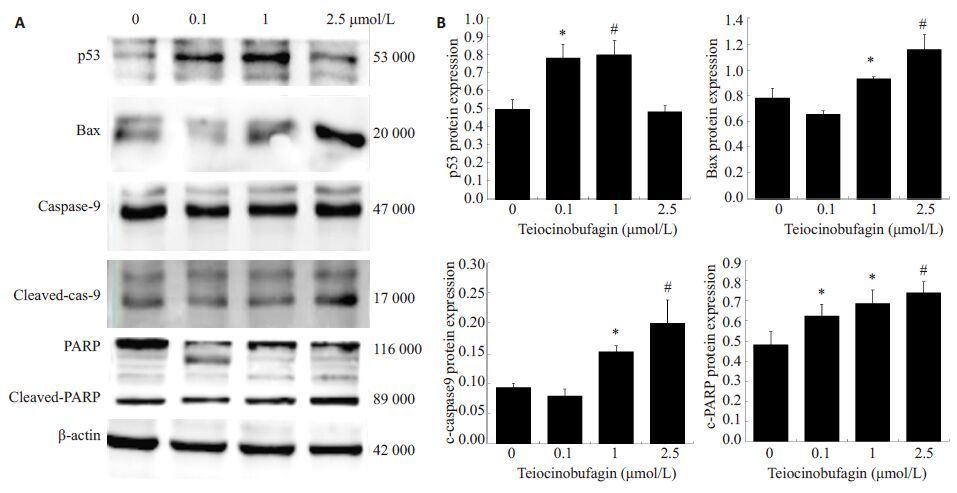
|
图4 Western blotting检测TBG对CRC细胞后凋亡相关蛋白表达的作用 Fig.4 Effects of telocinobufagin on expressions of apoptosis-related proteins in CRC cells. A: Protein expression detected by Western blotting; B: Semi-quantitative analysis of protein expressions. *P<0.05, #P<0.01 vs control (0 μmol/L). |
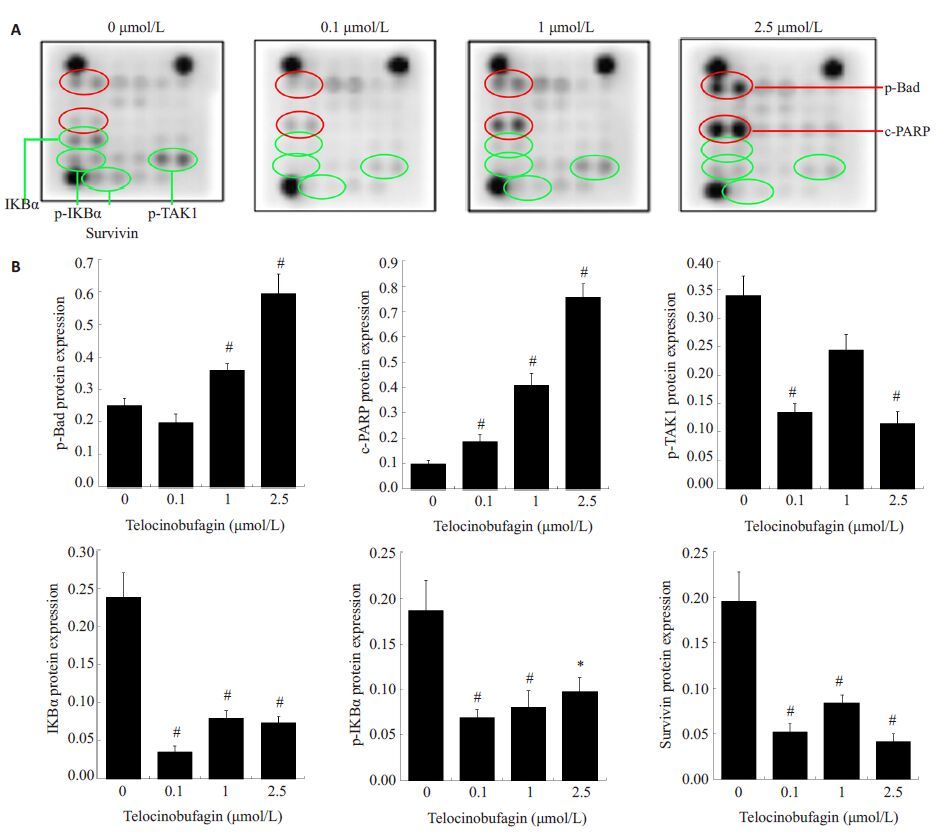
抗体芯片结果显示,TBG显著增加Bad磷酸化和PARP的片段化,与Western blot结果一致。磷酸化IκBα、磷酸化TAK1 以及survivin的蛋白表达在TBG作用下呈下降趋势。上述结果均表明TBG可能通过调节多个应激与凋亡信号分子途径诱导CRC细胞发生凋亡。
3 讨论蟾酥始载于唐·甄权所著《药性论》,至今已有1400多年历史。明代陈实功著《外科正宗》中蟾酥丸用于治疗痈疽恶疮;《增补万病回春》所录飞龙夺命丹以蟾酥为君药,焦树德先生建议葱白煎汤送服,用于治疗子宫颈癌、肠癌、肺癌等[7]。然而蟾酥辛、温、有毒,长期服用会产生严重的全身毒性,因此深入研究蟾酥有效成分的抗CRC活性及其机制并进行靶向改造是传统中药减毒增效的创新研发模式[9]。
TBG 以剂量和时间依赖的方式抑制SW480 和HCT116结肠癌细胞活力。荧光染色标记的凋亡小体,结合流式细胞术结果提示TBG降低CRC细胞活力与其诱导凋亡相关。TBG诱导线粒体膜电位降低并增加细胞内活性氧簇(ROS)水平。HCT116包含一个野生型的p53基因,野生型p53在G1期检查DNA损伤点并启动DNA修复,若修复失败则会诱导细胞凋亡[10]。p53是ROS诱导细胞凋亡的重要调控因子,ROS可以导致DNA损伤,进而激活共济失调性毛细血管扩张/和Rad3-相关性激酶-p53通路,p53 磷酸化会导致细胞周期分布发生改变,细胞中Bax 表达上升,Bcl-2 表达下降,细胞发生凋亡[11]。因此,TBG通过激活细胞内重要转录因子p53,上调凋亡相关基因Bax的表达导致凋亡通路的活化[6]。
聚ADP 核糖聚合酶(PARP)是一类存在于多数真核细胞中的蛋白质翻译后修饰酶,PARP在DNA损伤断裂时被激活,作为DNA损伤的分子感受器,识别、结合到DNA断裂处,激活、催化受体蛋白的聚ADP核糖基化作用,参与DNA的修复。ROS引起DNA损伤后,有缺口DNA 或DNA 碎片是PARP 的变构效应剂导致PARP与DNA缺口结合,活性可以增加500倍[12]。TBG可能通过诱导细胞内ROS导致DNA损伤,激活PARP而产生片段化,蛋白免疫印迹和蛋白芯片的结果均显示PARP片段化水平的增高。TBG引起的DNA损伤能够激活BAD的磷酸化[13],此前有研究表明顺铂通过细胞外信号调节蛋白激酶,提示TBG引起BAD的磷酸化可能与ROS引起的应激损伤相关。
RIP1被激活并快速募集多种衔接蛋白如TRAF2,泛素化促进TAK1 的磷酸化,刺激IκB激酶IKK 复合体形成,诱导IκBα磷酸化,使NF-κB从胞质转移到核内,诱导凋亡抑制蛋白(IAP)等转录,发挥抑制凋亡作用[14, 15]。TAK1的活化能够引起Wnt通路的活化,而TAK1的抑制则诱导KRAS阳性CRC细胞的凋亡。我们的结果提示TBG可能通过抑制TAK1 和IκBα磷酸化,前者降低KRAS和Wnt通路的活化,后者通过抑制NF-κB通路而产生凋亡诱导作用[14, 15]。存活素是IAP家族成员之一,具有抑制细胞凋亡作用,高表达于大多数恶性肿瘤组织,而在终末分化成熟的正常成人组织中无表达或低表达。存活素通过抑制Caspase-3、Caspase-7阻断细胞凋亡,TBG可能通过抑制NF-κB通路,降低存活素活性进而激活Caspase依赖的通路诱导细胞凋亡[17]。
综上所述,TBG通过诱导凋亡有效抑制多种CRC细胞增殖。TBG诱导凋亡的作用一方面与其诱导ROS产生,激活p53介导的Bax通路激活导致线粒体外膜通透性有关,另一方面也与抑制TAK1和IκBα,进而阻断IAP通路相关。
|
图5 TBG对CRC细胞应激与凋亡信号通路的作用 Fig.5 Effects of telocinobufagin on stress and apoptosis signaling pathway. A: Expression of stress and apoptosis proteins. Red circles indicate upregulated proteins and green ones indicate down-regulated proteins; B: Semi-quantitative analysis of phospho-Bad, cleaved PARP, phospho-TAK1, IKBɑ, phospho-IKBɑ and survivin in telocinobufagin-treated HCT116 cells. *P< 0.05, #P<0.01 vs control (0 μmol/L). |
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-32. ( 1) 1)
|
| [2] |
Kraus S, Nabiochtchikov I, Shapira S, et al. Recent advances in personalized colorectal cancer research[J]. Cancer Lett, 2014, 347 (1): 15-21. ( 1) 1)
|
| [3] |
El-Shami K, Oeffinger KC, Erb NL, et al. American cancer society colorectal cancer survivorship care guidelines[J]. CA Cancer J Clin, 2015, 65(6): 428-55. ( 1) 1)
|
| [4] |
Xu W, Jing L, Wang Q, et al. Bax-PGAM5L-Drp1 complex is required for intrinsic apoptosis execution[J]. Oncotarget, 2015, 6 (30): 30017-34. ( 3) 3)
|
| [5] |
张鹏伟, 江仁望, 叶文才, 等. 中华大蟾蜍蟾酥中蟾毒内酯类化学成分研究[J]. 中国中药杂志, 2014, 39(5): 841-5. ( 1) 1)
|
| [6] |
李玉云, 翟玮玮, 杨向荣, 等. 三七总皂苷对K562细胞增殖、凋亡及周 期的影响及机制[J]. 南方医科大学学报, 2015, 35(8): 1103-9. ( 1) 1)
|
| [7] |
杨雨, 徐文娟, 彭康, 等. 穗花杉双黄酮通过影响caspase-3 和 β-catenin表达诱导结肠癌细胞SW480凋亡[J]. 南方医科大学学报, 2014, 34(7): 1035-8. ( 2) 2)
|
| [8] | 焦树德. 方剂心得十讲[M]. 2版. 北京: 人民卫生出版社, 2011: 274-5. |
| [9] |
Sun XG, Wu WK, Lu ZP. Chinese integrative medicine: translation toward Person-Centered and balanced medicine[J]. Chin J Integr Med, 2012, 18(1): 3-6. ( 1) 1)
|
| [10] |
Borralho PM, Moreira Da Silva IB, Aranha MM, et al. Inhibition of Fas expression by RNAi modulates 5-fluorouracil-induced apoptosis in HCT116 cells expressing wild-type p53[J]. Biochim Biophys Acta, 2007, 1772(1): 40-7. ( 1) 1)
|
| [11] |
Jiang L, Hickman JH, Wang SJ, et al. Dynamic roles of p53- mediated metabolic activities in ROS-induced stress responses[J]. Cell Cycle, 2015, 14(18): 2881-5. ( 1) 1)
|
| [12] |
Hegedus C, Virag L. Inputs and outputs of poly(ADP-ribosyl)ation: Relevance to oxidative stress[J]. Redox Biol, 2014, 2C: 978-982. ( 1) 1)
|
| [13] |
Hayakawa J, Ohmichi M, Kurachi H, et al. Inhibition of BAD phosphorylation either at serine 112 via extracellular signal- regulated protein kinase cascade or at serine 136 via Akt cascade sensitizes human ovarian cancer cells to cisplatin[J]. Cancer Res, 2000, 60 (21): 5988-94. ( 1) 1)
|
| [14] |
Carter SL, Centenera MM, Tilley WD, et al. IκBα mediates prostate cancer cell death induced by combinatorial targeting of the androgen receptor[J]. BMC Cancer, 2016, 16(1): 141. ( 2) 2)
|
| [15] |
Cheng X, Shi W, Zhao C, et al. Triptolide sensitizes human breast cancer cells to tumor necrosis factor-α-induced apoptosis by inhibiting activation of the nuclear factor-κB pathway[J]. Mol Med Rep, 2016, 13(4): 3257-64. ( 2) 2)
|
| [16] | Singh A, Sweeney MF, Yu M, et al. TAK1 inhibition promotes apoptosis in KRAS-dependent colon cancers[J]. Cell, 2012, 148(4): 639-50. |
| [17] |
Singh N, Krishnakumar S, Kanwar RK, et al. Clinical aspects for survivin: a crucial molecule for targeting drug-resistant cancers[J]. Drug Discov Today, 2015, 20(5): 578-87. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
