2. 郑州大学第一附属医院心血管内科,河南 郑州 450052;
3. 中国人民解放军南部战区总医院干部病房,广东 广州 510014;
4. 解放军总医院第六医学中心心血管 病医学部,北京 100048
2. Department of Cardiology, First Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China;
3. Cadre's Ward, General Hospital of Southern Theater Command of PLA, Guangzhou 510000, China;
4. Department of Cardiology, Sixth Medical Center, Chinese PLA General Hospital, Beijing 100048, China
高海拔、低气压、低氧分压严重影响人类和其他动物的生存和生理功能[1]。在短时间内从平原到高原或从高原到高海拔地区,人们几乎总是会经历不同程度的头痛、头晕、疲劳、恶心、气短、心悸和心律失常事件的增加[2, 3]。我们初步发现,急性高原暴露后,C反应蛋白、天冬氨酸氨基转移酶、肌酐显著升高,而RR间期、射血时间、心率变异性指数显著降低[4]。大强度运动可引起相对或绝对心肌缺血缺氧,加重心肌结构和功能的损伤。急性低氧跑步是急性力竭运动的一种,该大鼠模型表现出一种特殊的心脏重构,其特征是左心室壁厚度增加,但没有心腔扩大。低氧运动触发身体的应激系统,导致应激因素增加和心肌损伤[5]。在正常的心脏收缩-舒张周期中,细胞外Ca2+通过L型钙通道内流,触发肌浆网(SR)通过兰尼碱受体2(RyR2)快速释放Ca2+。在哺乳动物心脏舒张过程中,SR膜上的Ca2+-ATP酶将很大一部分细胞内的Ca2+送回SR腔内,同时Na+/Ca2+交换体将部分Ca2+排出细胞外[6, 7]。急性力竭运动与心脏不良反应有关,包括心肌细胞Ca2+处置能力受损和线粒体呼吸,两者都与心脏功能障碍和心律失常事件有关[8]。然而,尚不清楚细胞机制是否参与了急性缺氧时的电重构。为揭示急性低氧运动对大鼠心肌损伤的机制,本研究旨在探讨钙电流和细胞内钙循环对急性低氧运动时心功能不全的影响。
1 材料和方法 1.1 动物模型及分组所有实验程序和方案均按照《实验动物管理条例》进行,并经解放军总医院动物实验伦理委员会批准(2017-X13-05)。将SD大鼠随机分为常氧安静组(NQ)、常氧跑步组(NR)、低氧安静组(HQ)和低氧跑步组(HR),每组10只。采用低压氧舱和跑轮疲劳装置建立大鼠急性低氧跑模型,模型构建时间为7 d。所有大鼠均日常饲养于SPF级饲养室内,常氧组大鼠置于大气压下,低氧组大鼠置于每日14:00置于低压氧舱内,每日在低氧环境下4 h。根据既往研究,实验开始时将低压氧舱内氧分压降至61.6 kPa(模拟高度4 km)及实验结束后将氧分压升至大气压的时间均为25 min,每0.5 h补换空气1次,但保持舱内氧分压恒定在61.6 kPa[9, 10]。两个跑步组每日总运动时间为4 h(低氧运动组每天在低压氧舱中运动4 h)。运动参数:运行速度18 m/min,每运动25 min后休息5 min,循环8次。
1.2 血清生物标志物检测采用酶联免疫吸附试验(ELISA)技术检测各组血清中超敏C反应蛋白(hs-CRP)、超氧化物歧化酶(SOD)、缺血修饰白蛋白(IMA)、心脏脂肪酸结合蛋白(h-FABP)等血液生物标志物。
1.3 心肌细胞HE染色切取适量的大鼠心肌并固定,按标准病理步骤制作心肌石蜡切片进行HE染色,显微镜下观察大鼠心肌病理变化并拍照保存。
1.4 分离单个心室肌细胞首先,将大鼠脱颈处死,取出心脏后进行主动脉逆行插管,利用Langendorff灌流装置,使用台式缓冲液灌流4~5 min。台式液pH7.40±0.05,组成(nmol/L):NaCl 113,KCl 4.7,KH2PO4 0.6,Na2HPO4 0.6,MgSO4 1.2,NaHCO3 12,KHCO3 12,HEPEs 10,Taurine 30,葡萄糖5,BDM 10。再用含1 mg/mL胶原Ⅱ和0.25 mg/mL胰蛋白酶的台氏液灌流11~14 min。取左心房,酶解后切成单个心房细胞。将心房肌细胞移入含钙1.0 mmol/L的测试液中,测定细胞内钙离子和膜电流/电位。
1.5 共聚焦钙成像在没有起搏或其他干预的情况下,通过钙火花或钙波来测量基础细胞内钙水平。SCAE是通过起搏或其他干预后肌浆网钙离子释放后的细胞内钙离子水平反映出来的,这也是通过钙火花和/或钙波来测量的。根据既往研究[11],采用共聚焦钙荧光检测细胞内Ca2+的变化,记录钙火花和钙波,测算钙释放达到峰值的时间和衰减时间。用Fluo-4 AM(Thermo Fisher Science)对Ca2+荧光反映的心房肌细胞内Ca2+水平进行定量,用激光扫描共聚焦显微镜(SP5,Leica Microsystems)记录不同条件下的基础Ca2+或Ca2+泄漏、自发性Ca2+释放事件(SCAE)和Ca2+循环。荧光激发波长为488 nm,发射波长 > 500 nm。
1.6 单细胞膜片钳APD50的变化主要与L型钙电流有关,因此采用膜片钳实验研究ICa, L与动作电位的变化。参考文献[12],用Axon-700B放大器(Axon Instruments)全细胞膜片钳技术记录ICa, L和动作电位。在电流钳模式下,采用2.5 ms/nA的去极化脉冲测量动作电位时长和动作电位幅值。在电压钳模式下,记录ICa, L,电压阶跃为10 mV,钳制电位为−40 mV~+70 mV。这些记录被用来建立电流-电压曲线(I~V)、稳态激活(SSA)或稳态失活(SSI)曲线。用Clampfit Version 10.4(Axon Instruments)和Origin分析膜片钳数据。
1.7 Western blotting检测Western blotting技术检测钙通道蛋白和钙释放再摄取单位的变化。从各组心肌细胞中提取总蛋白。一抗使用抗Cav1.2抗体(ABR, 1∶1000)、抗SERCA2a抗体(ABR,1∶1000)、抗RyR2抗体(ABCAM,1∶1000)、抗NCX1.1抗体(ABCAM,1∶1000)和抗GAPDH抗体(1∶1000)。用GAPDH的信号强度对条带强度进行归一化。所有实验都独立重复至少3次。Western blotting数据用Image J软件进行灰度分析。
1.8 数据分析采用SPSS V19软件进行统计分析。数据用均值±标准差表示。使用pCLAMP10.4版本和Origin进行数据分析。组间比较采用One-wayANOVA或t检验。P < 0.05被认为具有统计学意义。稳态活化(SSA)曲线用Boltzmann分布拟合为:G(T)/Gmax=1/(1+exp(Vm-V1/2)。使用公式G=Imax/(Vm−Ek)计算电导值,其中G是电导,Gmax是最大电导值,Imax表示峰值测试脉冲电流,Vm表示测试脉冲电压。
2 结果 2.1 各组氧化应激相关生物标志物变化与常氧安静组相比,HQ组和HR组SOD显著降低(P < 0.05或P < 0.01),提示急性低氧运动刺激时ROS产生增加。HR组h-FABP高于NQ组(P < 0.01)。NR组、HQ组、HR组hs-CRP、IMA水平均高于NQ组(P < 0.05或P < 0.01),HR组与HQ组、NR组比较差异有显著性(P < 0.05或P < 0.01,图 1)。
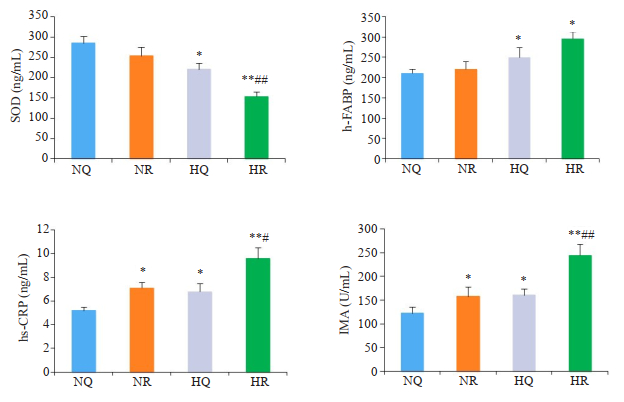
|
图 1 各组血清生物标志物检测 Fig.1 Detection of serum biomarkers in each group. *P < 0.05 vs NQ group; **P < 0.01 vs NQ group; #P < 0.05 vs NR or HQ group; ##P < 0.01 vs NR or HQ group. |
图 2显示NQ组细胞核结构清晰,横纹整齐,心肌纤维均匀。NR组心肌纤维轻度紊乱,中部有少量结缔组织散在分布,部分心肌肌浆浓缩,出现空泡。HR组心肌纤维呈波浪状排列,肌浆凝聚成不同厚度的红色染色横带,部分胞核浓缩甚至溶解,呈碎裂状。
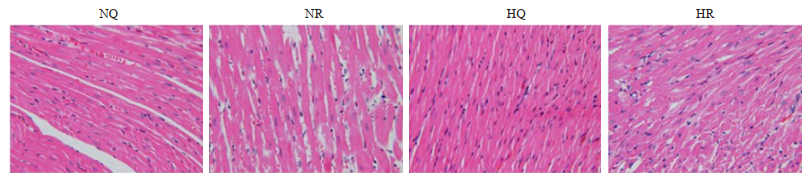
|
图 2 急性低氧跑对心室肌细胞结构的影响 Fig.2 Effects of forced running in acute hypoxia on ventricular myocardium tissue structure (Original magnification: ×400). |
每组均记录动作电位轨迹(图 3A)。3个应激组的APD50和APD90均长于NQ组。其中HR组APD50延长最为显著(P < 0.01,n=15),HR组APD50延长较NR组和HQ组明显(P < 0.05,n=15,图 3B)。图 3C也显示了APD90的类似结果。
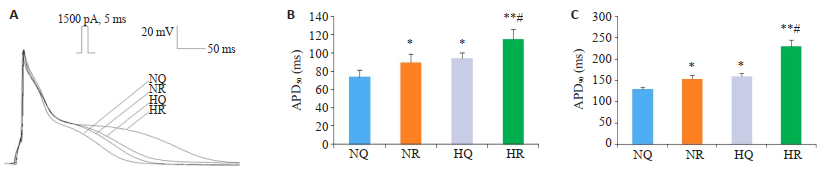
|
图 3 心室肌细胞动作电位 Fig.3 Action potential of ventricular myocytes. A: Record of action potential. B: APD50 of AP in the 4 groups. C: APD90 of AP in the 4 groups. *P < 0.05 vs NQ group; **P < 0.01 vs NQ group; #P < 0.05 vs NR or HQ group; ##P < 0.01 vs NR or HQ group. |
急性低氧运动模型心室肌细胞钙电流的变化结果显示,HR组ICa, L的电流密度明显高于其他3组(P < 0.01,n=15,图 4A、B)。I~V曲线显示,去极化电位在-20~+ 30 mV范围内,HR组细胞的ICa, L电流密度显著增加(图 4C)。HR组细胞的SSA曲线较NQ组明显向负电位方向偏移(P < 0.05,n=15,图 4D~F)。HR组细胞ICa, L的SSI曲线明显正移。虽然SSI失活曲线的斜率(Kinact)变化不大,但4组的半失活电压(Vinact,1/2)有显著差异。V1/2负移以HR组最明显,与NQ组、NR组、HQ组比较有显著性差异(P < 0.05或P < 0.01,n=15,图 4G~I)。
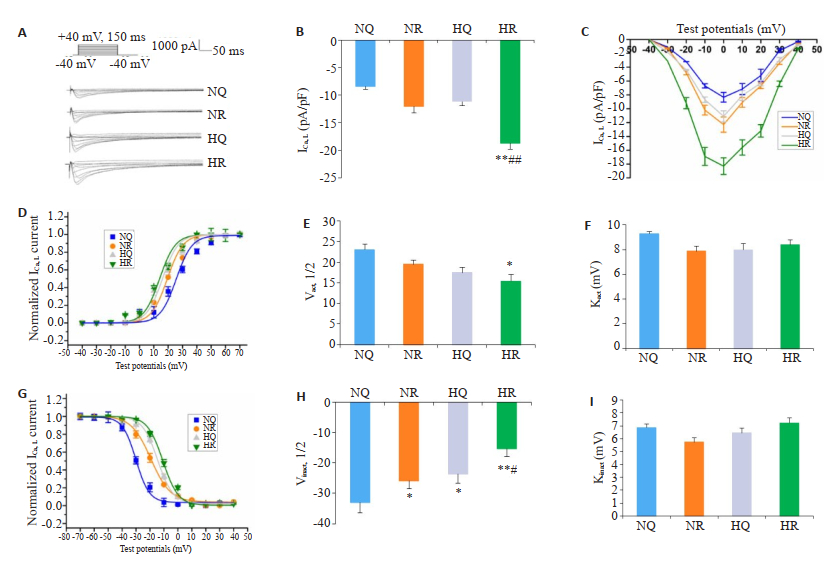
|
图 4 心室肌细胞ICa, L Fig.4 ICa, L of ventricular myocytes. A: Representative current traces of ICa, L in the 4 groups. B: Current densities of ICa, L in the 4 groups. C: Representative current-voltage relationship (voltage-dependence) of ICa, L in the 4 groups. D-F: Steady-state activation (SSA) curve of ICa, L in the 4 groups. G-I: steady-state inactivation (SSI) curve of ICa, L in the 4 groups. *P < 0.05 vs NQ group; **P < 0.01 vs NQ group; #P < 0.05 vs NR or HQ group; ##P < 0.01 vs NR or HQ group. |
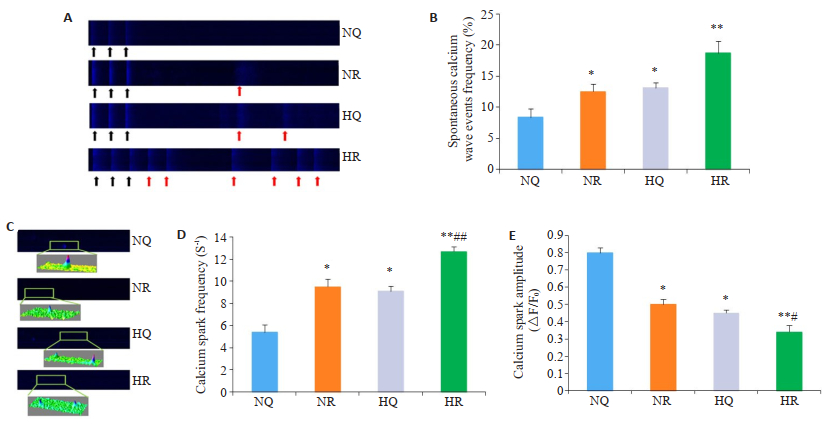
在急性缺氧应激条件下,细胞内钙离子的基线水平高于NQ肌细胞,这表明HR组的肌浆网钙离子泄漏。1.0 Hz起搏后,NR、HQ和HR组的自发性钙波事件均高于NQ组,以HR组变化最明显(P < 0.05或P < 0.01,n=10,图 5A、B)。3组应激心肌细胞钙火花频率增加,火花幅值降低,HR组变化更明显(P < 0.05或P < 0.01,n=10,图 5C~E)。
|
图 5 各组细胞自发性钙释放和钙火花 Fig.5 Ca2+sparks and SCaEs of the ventricular myocytes. A: Spontaneous calcium waves events of ventricular myocytes in four groups. B: Spontaneous calcium wave events frequency of the ventricular myocytes in the 4 groups. C: Calcium sparks of ventricular myocytes in the 4 groups and selected calcium spark regions were fitted to 3D images using Image J. D: Calcium sparks frequency of ventricular myocytes in the 4 groups. E: Calcium sparks amplitude of ventricular myocytes in the 4 groups (*P < 0.05 vs NQ group; **P < 0.01 vs NQ group; #P < 0.05 vs NR or HQ group; ##P < 0.01 vs NR or HQ group). |
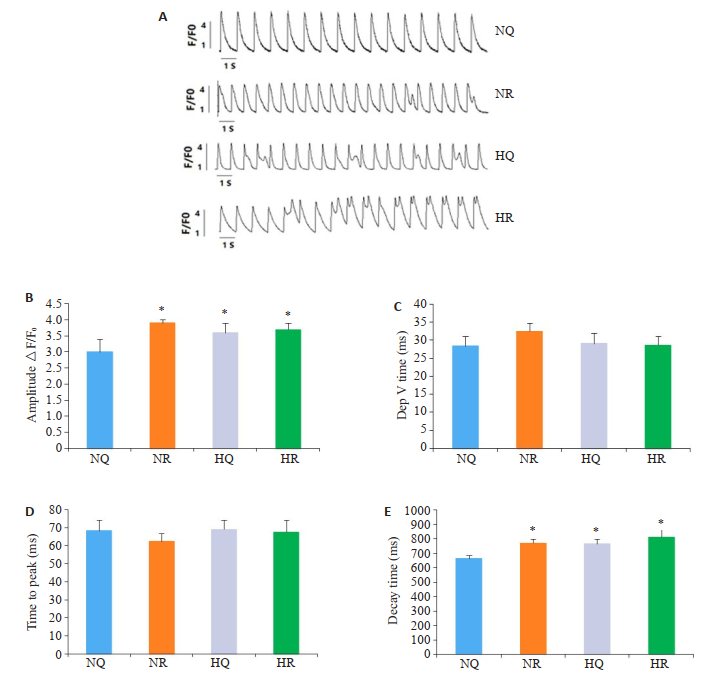
在1.0 nA/2.5 ms起搏条件下记录4组细胞的全部电活动。随着应激状态的增加(NR组和HQ组),出现膜振荡的细胞比例增加。这种差异在HR组进一步增强。当刺激频率为1.0 Hz时,与NQ组相比,HR组心室肌细胞钙释放峰值升高,钙离子回流吸收延迟(P < 0.01,n=10,图 6A、B、E)。各组间钙释放最大速率时间和钙释放达峰时间差异均无统计学意义(图 6C、D)。
|
图 6 心室肌细胞的膜振荡 Fig.6 Membrane oscillations of the ventricular myocytes. A: Spontaneous calcium release of ventricular myocytes in the 4 groups. B-E: Amplitude ΔF/F0, Dep V time, Time to peak and Decay time of spontaneous calcium release of ventricular myocytes in the 4 groups (*P < 0.05 vs NQ group). |
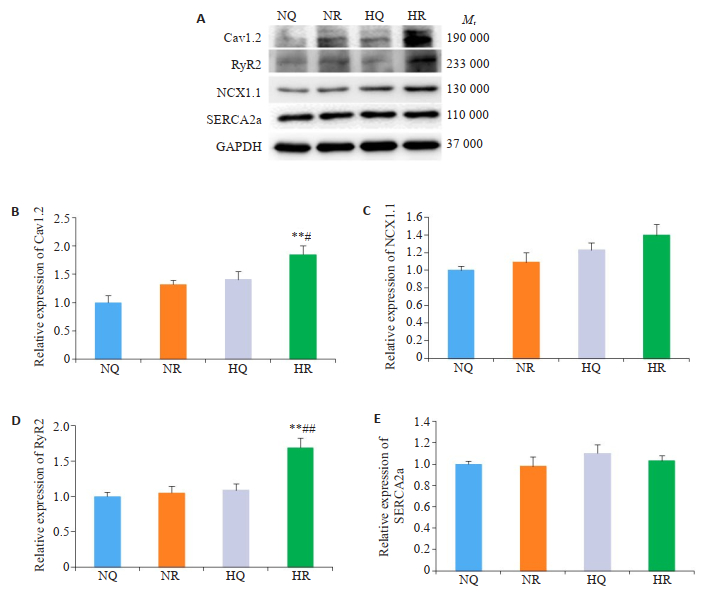
用Western blotting方法比较4组大鼠心室肌细胞蛋白的水平。HR组Cav1.2通道和RyR2蛋白水平明显高于NQ组、NR组和HQ组(P < 0.05或P < 0.01,n=3,图 7A、B、D)。4组NCX1.1和SERCA2a蛋白水平无明显变化(P > 0.05,n=3,图 7A、C、E)。
|
图 7 各组钙通道蛋白与钙转运蛋白的改变 Fig.7 Changes in protein expression of calcium cycle of ventricular myocytes. A: Expression of calcium cycle proteins of ventricular myocytes in the 4s groups. B: Relative expression of Cav1.2 protein in the 4 groups; C: Relative expression of NCX1.1 protein in the 4 groups; D: Relative expression of RyR2 protein in the 4 groups; E: Relative expression of SERCA2a protein in the 4 groups (**P < 0.01 vs NQ group; #P < 0.05 vs NR or HQ group; ##P < 0.01 vs NR or HQ group). |
高原低氧环境对心脏功能的危害已被广泛认识,运动应激对心肌损伤的研究也很多。剧烈运动使全身和组织的耗氧量增加20倍,增加线粒体运输系统的电子泄漏,细胞内抗氧化剂和氧化剂的动态平衡受到破坏[13, 14]。然而,急性低氧运动应激后心功能损伤的机制尚不清楚。本研究的主要发现是急性低氧运动对大鼠心肌功能的损害与钙电流增加和细胞内钙超载有关。复合应激的作用明显强于急性缺氧或单独力竭运动。这将是运动负荷和低氧暴露期间心脏功能障碍和心律失常事件的部分解释[15]。
我们的结果显示HR组h-FABP和IMA水平较高,而单独低氧或跑步组增加较小。h-FABP和IMA被认为是检测心肌缺血后早期损伤的新型生物标志物[16, 17]。h-FABP是一种相对分子质量为145 000的低分子蛋白质,它在心肌细胞中含量丰富。活跃地参与氧化过程,在线粒体中产生能量。IMA是心肌缺血的一个非常敏感的标记物,它是血清白蛋白的一种改变类型,是在缺血、缺氧、酸中毒等条件下的氧化应激条件下形成的[18]。细胞缺氧与活性氧自由基(ROS)的产生增加有关,超氧化物歧化酶(SOD)具有较强的清除自由基活性。SOD降低时ROS水平升高,导致细胞损伤,从而诱导心肌细胞凋亡或坏死[19]。我们发现急性低氧运动模型大鼠心室肌细胞中SOD含量急剧下降,认为急性低氧运动导致心肌组织氧供需失衡。我们的研究突出了氧化应激在急性低氧运动中心肌损伤的重要性,主要表现为IMA和h-FABP的升高、SOD的降低以及心肌组织的破坏。这可能导致心肌功能障碍和电重构,并引发心律失常。进一步我们发现HR组心肌纤维呈波浪状,横带增厚,部分细胞核浓缩甚至溶解。
以往的研究表明,急性高原暴露后心率变异性指数明显降低,该指标反映每个心率周期变化的指标,主要用于预测心脏性猝死和心律失常[20, 21]。本研究发现急性低氧运动时心肌细胞的电生理变化主要表现为动作电位时程的延长,特别是HR组的APD50延长比NR组和HQ组更显著。提示急性低氧运动时心肌细胞复极延长,可能诱发早期后除极(EAD),引起EAD诱发的触发活动和早搏。触发活动扩散到邻近心肌区域形成折返,导致EAD诱发的触发性心律失常[22, 23]。众所周知,APD50的延长主要涉及细胞膜L型钙电流密度的改变。我们发现急性低氧运动模型大鼠心室肌细胞钙电流明显增加。门控机制研究显示,模型大鼠钙通道稳态失活曲线向去极化方向移动,表明在相同去极化电压下,钙通道失活减缓,通道电流增大[24]。这提示钙电流密度的增加主要与钙通道的稳态失活有关。也就是说,与NQ组相比,在相同的去极化电位刺激下,HR组钙通道稳态失活过程减慢,开放的通道数增加。这会导致模型大鼠的L型钙电流幅度和密度升高。与NQ组相比,HR组钙通道α亚单位Cav1.2蛋白表达上调。与NQ组相比,无论是低氧运动还是力竭运动,Cav1.2蛋白的表达均无显著差异。一种可能的解释是,急性缺氧跑步模型大鼠心室肌细胞钙电流的增加来自两条途径:一条是钙通道稳态失活过程减慢,另一条是参与心肌细胞膜钙通道蛋白表达增加[25]。
急性低氧运动时细胞内Ca2+明显升高。在1.0 Hz起搏条件下,HR组较NQ组心肌细胞表现出更频繁的自发性钙波,细胞膜振荡的比例也随之增加。长期以来,细胞内钙稳态一直被认为是对模拟缺血刺激的典型反应,如缺氧、营养不良以及心肌细胞代谢抑制。细胞内钙的增加主要来自两个过程:一是钙离子通过L型钙通道从细胞外液中内流,二是通过兰尼定受体2(RyR2)肌浆网(SR)释放,称为钙依赖性钙释放过程。细胞内Ca2+浓度降低主要通过Ca2+-ATP酶(SERCA2a)摄取Ca2+进入SR腔而恢复到舒张期水平[26, 27]。在本实验中,我们发现RyR2受体的表达明显上调。这表明细胞内Ca2+的增加主要是由于SR释放的增加所致。尽管HR组心室肌细胞钙离子回流吸收延迟,但SERCA2a和NCX1.1蛋白的表达在本实验中未检测到明显变化。综合以上结果,我们认为急性低氧运动模型细胞内钙超载主要是由于RyR2受体释放功能增强所致。
本研究证实了急性低氧运动时ROS和细胞内钙离子的增加,但氧化应激是否与细胞内钙离子的变化直接相关,还是受其他信号通路的调控,目前尚不清楚。我们知道多次间歇性低氧或适度运动对心肌功能有保护作用,被称为“低氧预适应”或“运动预适应”[28]。在本研究中,我们采用单一的急性低氧运动模式对大鼠进行刺激,发现对心脏功能有不利影响。单次和多次急性低氧运动对心脏的影响是否存在相同或相反的关系?这需要进一步探索。在此,我们发现在急性低氧运动模型中,ROS的产生和细胞内Ca2+水平增加。这些发现加深了人们对急性低氧运动后心肌细胞钙稳态的重要作用的理解。Ca2+处理不当与氧化应激介导的心肌细胞死亡、结构和电重构密切相关。这可能在一定程度上解释了高原力竭运动时心脏功能障碍和心律失常增加的原因。
| [1] |
West JB. High-altitude medicine[J]. Am J Respir Crit Care Med, 2012, 186(12): 1229-37. DOI:10.1164/rccm.201207-1323CI |
| [2] |
Basnyat B, Hofmeyr R, Tölken G, et al. Acute high-altitude illness[J]. SAfr Med J, 2017, 107(12): 1047-8. |
| [3] |
Hoiland RL, Howe CA, Coombs GB, et al. Ventilatory and cerebrovascular regulation and integration at high-altitude[J]. Clin Auton Res, 2018, 28(4): 423-35. DOI:10.1007/s10286-018-0522-2 |
| [4] |
Li ZB, Liu CW, Guo J, et al. Early warning of acute altitude sickness by physiological variables and noninvasive cardiovascular indicators[J]. Chin Med Sci J, 2020, 35(1): 13-9. |
| [5] |
Perez AC, Cabral de Oliveira AC, Estevez E, et al. Mitochondrial, sarcoplasmic membrane integrity and protein degradation in heart and skeletal muscle in exercised rats[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2003, 134(2): 199-206. |
| [6] |
Eisner DA, Caldwell JL, Kistamás K, et al. Calcium and excitation-contraction coupling in the heart[J]. Circ Res, 2017, 121(2): 181-95. DOI:10.1161/CIRCRESAHA.117.310230 |
| [7] |
Eisner DA. Ups and Downs of calcium in the heart[J]. J Physiol, 2018, 596(1): 19-30. DOI:10.1113/JP275130 |
| [8] |
Ljones K, Ness HO, Solvang-Garten K, et al. Acute exhaustive aerobic exercise training impair cardiomyocyte function and calcium handling in Sprague-Dawley rats[J]. PLoS One, 2017, 12(3): e0173449. DOI:10.1371/journal.pone.0173449 |
| [9] |
Oláh A, Németh BT, Mátyás C, et al. Cardiac effects of acute exhaustive exercise in a rat model[J]. Int J Cardiol, 2015, 182: 258-66. DOI:10.1016/j.ijcard.2014.12.045 |
| [10] |
Poole DC, Copp SW, Colburn TD, et al. Guidelines for animal exercise and training protocols for cardiovascular studies[J]. Am J Physiol Heart Circ Physiol, 2020, 318(5): H1100-38. DOI:10.1152/ajpheart.00697.2019 |
| [11] |
Zhang JC, Wu HL, Chen Q, et al. Calcium-mediated oscillation in membrane potentials and atrial-triggered activity in atrial cells of Casq2 R33Q/R33Q mutation mice[J]. Front Physiol, 2018, 9: 1447. DOI:10.3389/fphys.2018.01447 |
| [12] |
Zhao J, Zhou CL, Xia ZY, et al. Effects of dexmedetomidine on L-type calcium current in rat ventricular myocytes[J]. Acta Cardiol Sin, 2013, 29(2): 175-80. |
| [13] |
Bucioli SA, de Abreu LC, Valenti VE, et al. Effects of vitamin E supplementation on renal non-enzymatic antioxidants in young rats submitted to exhaustive exercise stress[J]. BMC Complement Altern Med, 2011, 11: 133. DOI:10.1186/1472-6882-11-133 |
| [14] |
Noakes TD, Peltonen JE, Rusko HK. Evidence that a central governor regulates exercise performance during acute hypoxia and hyperoxia[J]. J Exp Biol, 2001, 204(Pt 18): 3225-34. DOI:10.1242/jeb.204.18.3225 |
| [15] |
Coustet B, Lhuissier FJ, Vincent R, et al. Electrocardiographic changes during exercise in acute hypoxia and susceptibility to severe high-altitude illnesses[J]. Circulation, 2015, 131(9): 786-94. DOI:10.1161/CIRCULATIONAHA.114.013144 |
| [16] |
Lippi G, Montagnana M, Guidi GC. Albumin cobalt binding and ischemia modified albumin generation: an endogenous response to ischemia?[J]. Int J Cardiol, 2006, 108(3): 410-1. DOI:10.1016/j.ijcard.2005.03.040 |
| [17] |
Thielmann M, Pasa S, Holst T, et al. Heart-type fatty acid binding protein and ischemia-modified albumin for detection of myocardial infarction after coronary artery bypass graft surgery[J]. Ann Thorac Surg, 2017, 104(1): 130-7. DOI:10.1016/j.athoracsur.2016.10.051 |
| [18] |
Apple FS, Quist HE, Otto AP, et al. Release characteristics of cardiac biomarkers and ischemia-modified albumin as measured by the albumin cobalt-binding test after a marathon race[J]. Clin Chem, 2002, 48(7): 1097-100. DOI:10.1093/clinchem/48.7.1097 |
| [19] |
Quan HL, Koltai E, Suzuki K, et al. Exercise, redox system and neurodegenerative diseases[J]. Biochim Biophys Acta Mol Basis Dis, 2020, 1866(10): 165778. DOI:10.1016/j.bbadis.2020.165778 |
| [20] |
Huang HH, Tseng CY, Fan JS, et al. Alternations of heart rate variability at lower altitude in the predication of trekkers with acute mountain sickness at high altitude[J]. Clin J Sport Med, 2010, 20(1): 58-63. DOI:10.1097/JSM.0b013e3181cae6ba |
| [21] |
Hamilton JL, Alloy LB. Atypical reactivity of heart rate variability to stress and depression across development: systematic review of the literature and directions for future research[J]. Clin Psychol Rev, 2016, 50: 67-79. DOI:10.1016/j.cpr.2016.09.003 |
| [22] |
Wit AL. Afterdepolarizations and triggered activity as a mechanism for clinical arrhythmias[J]. Pacing Clin Electrophysiol, 2018: 2018Jun19.
|
| [23] |
Nánási PP, Szabó Z, Kistamás K, et al. Implication of frequencydependent protocols in antiarrhythmic and proarrhythmic drug testing[J]. Prog Biophys Mol Biol, 2020, 157: 76-83. DOI:10.1016/j.pbiomolbio.2019.11.001 |
| [24] |
Kubalová Z. Inactivation of L-type calcium channels in cardiomyocytes. Experimental and theoretical approaches[J]. Gen Physiol Biophys, 2003, 22(4): 441-54. |
| [25] |
Catterall WA. Voltage-gated calcium channels[J]. Cold Spring Harb Perspect Biol, 2011, 3(8): a003947. |
| [26] |
Shattock MJ, Ottolia M, Bers DM, et al. Na+/Ca2+ exchange and Na+/K+-ATPase in the heart[J]. J Physiol, 2015, 593(6): 1361-82. DOI:10.1113/jphysiol.2014.282319 |
| [27] |
Stammers AN, Susser SE, Hamm NC, et al. The regulation of sarco (endo)plasmic Reticulum calcium-ATPases (SERCA)[J]. Can J Physiol Pharmacol, 2015, 93(10): 843-54. DOI:10.1139/cjpp-2014-0463 |
| [28] |
Li SJ, Hafeez A, Noorulla F, et al. Preconditioning in neuro-protection: from hypoxia to ischemia[J]. Prog Neurobiol, 2017, 157: 79-91. |
 2022, Vol. 42
2022, Vol. 42

